
- •Министерство образования Российской Федерации
- •Химическое Строение и свойства текстильных волокон
- •Текстильные волокна
- •1. Классификация
- •2. Структура волокон
- •2.1. Молекулярная структура
- •2.2. Надмолекулярная структура
- •2.3. Микроструктура
- •Целлюлозные волокна
- •1. Классификация
- •2. Молекулярное строение целлюлозы
- •3. Надмолекулярное строение целлюлозы
- •4. Химические свойства целлюлозных волокон
- •5. Особенности строения и свойств ацетатных волокон
- •Белковые волокна
- •1. Шерсть
- •1.1. Молекулярное строение кератина
- •1.2. Надмолекулярное строение кератина
- •1.3. Химические свойства шерсти
- •Синтетические волокна
- •153000 Г. Иваново, пр. Ф. Энгельса, 21
5. Особенности строения и свойств ацетатных волокон
Элементарным звеном ацетатного волокна является не β-D-глюкопираноза, а её уксуснокислый эфир (ацетат). В ацетатных волокнах гидроксильные группы частично заменены на эфирные, а в триацетатных – практически полностью.
Ацетатные волокна, как и любые эфиры, чувствительны к гидролизу, который наиболее эффективно протекает в щелочах (омыление) и менее в кислотах. Концентрированными щелочами при низких температурах и разбавленными при высоких ацетилцеллюлозу можно полностью перевести в гидратцеллюлозу.
Гидрофильность ацетатных волокон ниже целлюлозных, что объясняется меньшим количеством гидроксильных групп. По гидрофильности они занимают промежуточное положение между целлюлозными и синтетическими. Как следствие более низкой гидрофильности отличительными свойствами ацетатных волокон являются: 1 – меньшее набухание в воде и меньшая потеря прочности в мокром состоянии, чем у гидратцеллюлозных волокон; 2 – повышенная электризуемость.
К воздействию окислителей и микроорганизмов ацетатные волокна устойчивее целлюлозных волокон.
Ацетатные волокна термопластичны, что приближает их к синтетическим волокнам. При 180-190оС они начинают деформироваться, а при 230-290о – плавиться с разложением.
Белковые волокна
Белковыми называют волокна животного происхождения, в основе которых лежит природный полимер-белок. Наибольшее значение имеют шерсть и шёлк, искусственные белковые волокна (из казеина молока или бобов) не нашли практического применения.
1. Шерсть
Наиболее важным белковым волокном в практическом отношении является шерсть различных животных (овец, коз, верблюдов, ламы и т.д.).
В отличие от целлюлозных волокон шерстяное обладает сложным морфологическим строением. В элементарном волокне шерсти выделяют три слоя: чешуйчатый, корковый, сердцевинный. Каждому слою соответствует своя разновидность клеток, отличающихся по форме, размеру, составу и свойствам. Чешуйчатый слой представляет собой внешнюю защитную оболочку волокна (рис. 7). Основную массу волокна (90%) составляет внутренний корковый слой, образованный совокупностью веретёнообразных клеток, соединённых межклеточным веществом. Сердцевинный слой характерен только для волокон грубой шерсти, он представляет собой внутренний канал, заполненный высохшими клетками и воздухом.

Рис.7. Микрофотография поверхности шерстяного волокна
1.1. Молекулярное строение кератина
Макромолекулы белка построены из остатков -аминокислот (мономеры), соединённых между собой пептидной связью. Схематично реакцию образования пептида из -аминокислот можно представить следующим образом:
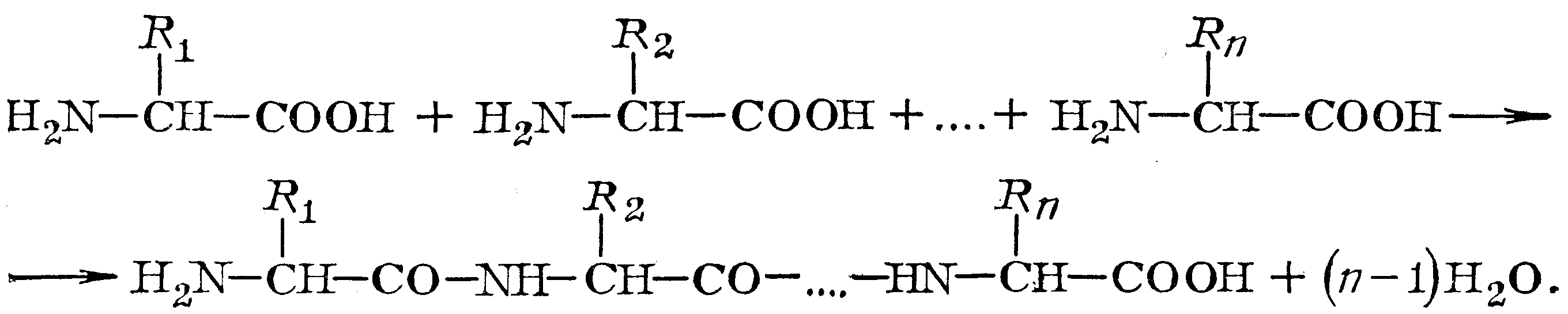 ,
,
где R1, R2, Rn – остатки -аминокислот
В кератине шерсти обнаружено 19 остатков -аминокислот (R1-R19), содержащих различные функциональные группы (активные центры), способные взаимодействовать как между собой, так и с отделочными препаратами – -OH, -NH2, -SH, -COOH. Отличительной особенностью шерсти является наличие в ней атомов серы. Последовательность соединения аминокислот в кератине пока не установлена.
Макромолекула кератина имеет конформацию спирали, которая стабилизируется внутримолекулярными взаимодействиями активных центров, в основном за счёт образования водородных связей между –СО– и –NН– группами соседних витков спирали (рис. 8). Такая форма макромолекулы в значительной степени определяет упругоэластические свойства шерстяного волокна: спираль, как пружина, растягивается при деформационных нагрузках и возвращается в исходное положение после их снятия.
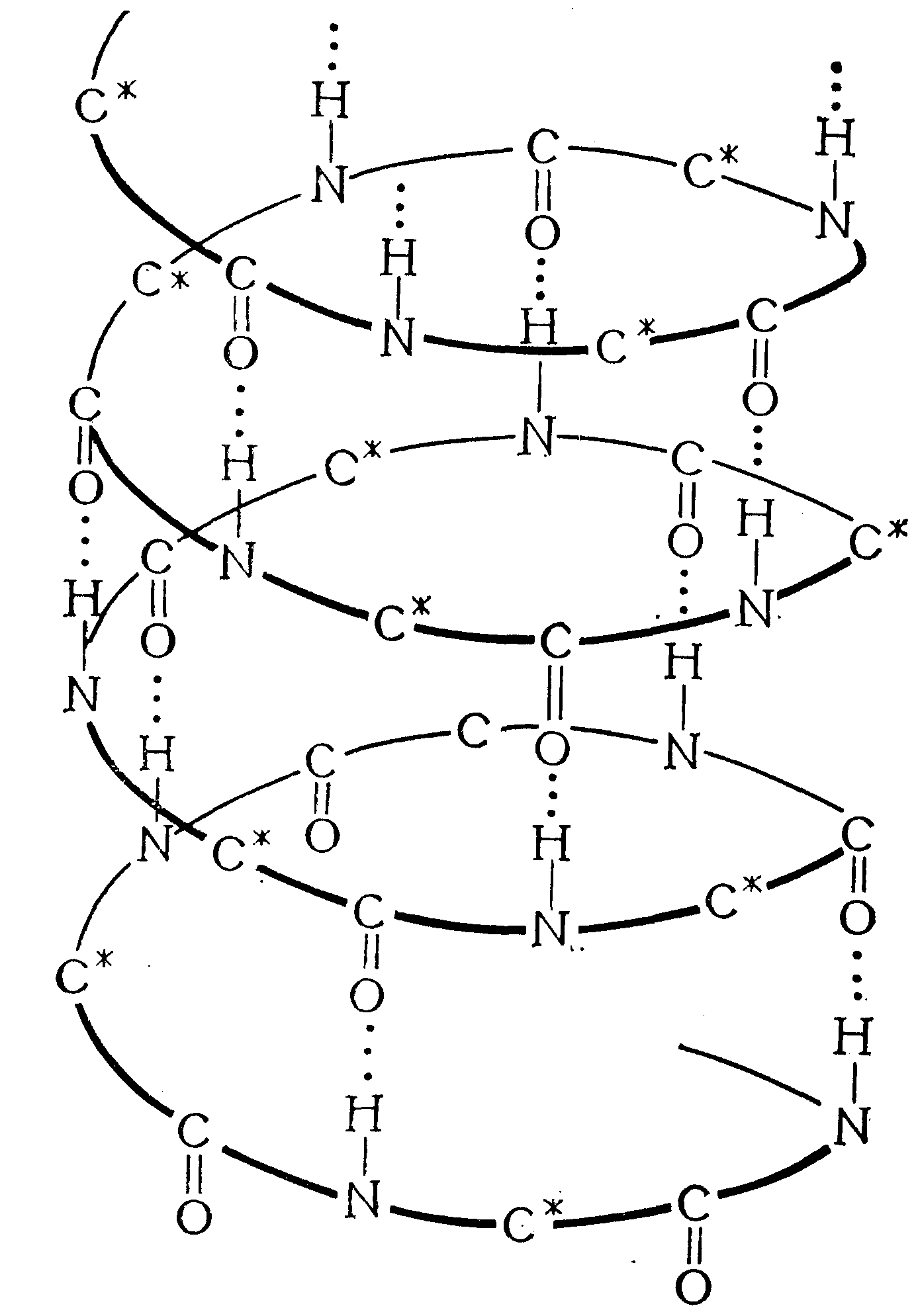
Рис. 8. Схема -спирали полипептидной цепи
