
- •Содержание разделов дисциплины Введение
- •1. Основные закономерности протекания химических процессов
- •2. Окислительно-восстановительные реакции
- •3. Учение о растворах
- •4. Строение вещества
- •5. Комплексные соединения
- •6. Химия элементов
- •Задание к занятию № 2
- •Лабораторная работа №2 «Определение теплоты нейтрализации».
- •IV. Самостоятельная работа №1. Способы выражения концентрации растворов.
- •Термодинамические свойства некоторых веществ.
- •Факторы, определяющие ход процесса
- •Лабораторная работа 2 «Определение теплоты нейтрализации»
- •Лабораторная работа № 2 Определение теплоты нейтрализации
- •Термодинамические свойства некоторых веществ
- •Лабораторная работа 3. «Влияние различных факторов на положение равновесия химической реакции».
- •Лабораторная работа № 3 Влияние различных факторов на положение равновесия химической реакции.
- •Вариант 0
- •Задание к занятию №3.
- •II. Упражнения:
- •Самостоятельная работа №2. Элементы химической термодинамики. Окислительно-восстановительные реакции Вариант 0
- •I. Тест (Ответ: цифра и буква).
- •II. Упражнение и задача.
- •Задание к занятию №5
- •II. Решить задачи.
- •Задание к занятию №6
- •II. Решить упражнения и задачи.
- •III. Лабораторная работа.
- •Самостоятельная работа № 3. Учение о растворах Вариант №0
- •Задание к занятию №7 Контрольная работа №2
- •Контрольная работа №2 «Учение о растворах» Вариант 0
- •Задание к занятию №8
- •Самостоятельная работа № 4. Строение атома и периодический закон д.И. Менделеева. Химическая связь. Вариант № 0
- •Задание к занятию №9
- •III. Лабораторная работа №:7.
- •Задание к занятию №10 по теме «s-элементы»
- •II. Выполнить задания:
- •III. Лабораторная работа №:8.
- •Задание к занятию №12
- •II. Выполнить задания:
- •III. Лабораторная работа. Химические свойства d - элементов и их соединений (vib - viib).
- •Задание №13 по теме «d-элементы. Часть 2.»
- •II. Выполнить задания:
- •III. Лабораторная работа.
- •Самостоятельная работа 7. Свойства d-элементов Вариант 0
- •Задание №14 по теме «p-элементы iiiа – vа групп»
- •II. Решить задачи:
- •III. Лабораторная работа.
- •Задание №15 по теме «p-элементы VI и VII групп»
- •II. Выполнить задание:
- •III. Лабораторная работа.
- •Самостоятельная работа № 8. Свойства p-элементов Вариант 0
Задание к занятию №9
I. Теория. Комплексные соединения (раздел программы 2.2).
II. Выполнить задания:
1. Назвать комплексные соединения:
K[Ag(CN)2], [Co(NH3)5(NO2)]Cl2, (NH4)2[Pt(OH)2Cl2],
K2[PtBr(NO2)5], [Сu(NН3)4][ PtCl4], K2[Pt(SCN)4].
Определить заряды комплексного иона и комплексообразователя, координационное число комплексообразователя.
2. Написать координационные формулы следующих соединений: тетрахлороаурат (III) калия, гексагидроксохромат (III) бария, гексафтороалюминат (III) натрия, тиоцианатотрицианокупрат (II) бария, хлорид гексааквахрома (III), гидроксид гексаамминкобальта (II).
3. Написать уравнения ионизации в растворах следующих координационных соединений и выражения для общей константы нестойкости: K[Au(CN)2] [Cu(NH3)4]SO4.
4. Рассчитать концентрации ионов калия, ионов – комплексообразователя и лигандов в растворе K[Au(CN)2] (Кнест=5,0 10-39) с концентрацией комплексного соединения – 0,1 моль/л.
5. Рассчитать концентрацию ионов Сu+ в 0,05 М растворе К[Сu(СN)2], содержащем 0,01 моль KCN в 1 литре раствора.
III. Лабораторная работа №:7.
IV. Самостоятельная работа № 5 (в тетради для «0»-х вариантов
Задача № 1. Рассчитать концентрацию ионов – комплексообразователя в 1 л раствора хлорида диамминсеребра (I) с концентрацией 0,01 моль/л. Kнест.([Ag(NH3)2]+) = 9,3 10-8.
Алгоритм решения:
Запишите:
Запишите уравнение реакции диссоциации комплексного соединения в водном растворе.
Запишите уравнение диссоциации комплексного иона.
Запишите выражение для Кнест. комплексного катиона.
Выразить концентрацию, продиссоциированного комплексного иона через Х.
Выразить концентрацию ионов, в состоянии равновесия.
Решить задачу. Рассчитайте [Ag+], подставив в нее соответствующие величины.
Дано: С ([Ag(NH3)]) = 0,01 моль/л, Kнест.([Ag(NH3)2]+) = 9,3 10-8 .[Ag]+ = ? |
Решение. 1. [Аg(NН3)2]С1 → [Ag(NH3)2]+ + С1- 2. [Ag(NH3)2]+ Ag+ + 2NН3, |
3.
Kнест.([Ag(NH3)2]+)
=
 ,
,
4. С([Ag(NH3)2]+)дисс. = х моль,
5. равновесные концентрации:
[Ag+] = х моль, [NH3] = 2 х моль,
[Ag(NH3)2]+. = (0,01 – х) моль, т.к х – мало, [Ag(NH3)2]+. = 0,01 моль,
6.
9,3
10-7=
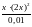 =
=
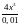 ;
;
 моль/л.
моль/л.
Ответ: 1,32 10-3 моль/л.
Пример 2. Вычислить концентрацию ионов серебра в растворе [Аg(NН3)2]С1, с концентрацией 0,02 моль/л, содержащем в 1 л раствора 0,1 моль NН3.
Kнест.([Ag(NH3)2]+) = 9,3 10-8.
Алгоритм решения:
Запишите уравнение реакции диссоциации комплексного соединения в водном растворе.
Запишите уравнение диссоциации комплексного иона.
Запишите выражение для Кнест. комплексного катиона.
Решить задачу. Рассчитайте [Ag+], подставив в нее соответствующие величины.
Дано: С ([Ag(NH3)]) = 0,02 моль/л, С (NH3) = 0,1 моль/л, Kнест.([Ag(NH3)2]+) = 9,3 10-8 .[Ag]+ = ? |
Решение. 1. [Аg(NН3)2]С1 → [Ag(NH3)2]+ + С1- 2. [Ag(NH3)2]+ Ag+ + 2NН3, |
3. Kнест.([Ag(NH3)2]+) = ,
4. Ионизация комплексного иона [Аg(NН3)2]+ в растворе аммиака подавляется. Поэтому, как и в случае ионизации слабых электролитов, принимаем концентрацию [Ag(NH3)2]+ и NН3 равной их исходным концентрациям в растворе.
[Ag+]
=
 ,
[Ag+]
=
,
[Ag+]
=
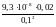 = 1,86
10-7моль/л.
= 1,86
10-7моль/л.
Ответ: 1,86 10-7 моль/л.
Лабораторная работа №:7.
Изучение реакций комплексообразования
Цель: изучить реакции образования аммино- и гидроксокомплексов.
Опыт 1. Образование гидроксокомплексов d- и р-металлов. а) Предварительно получают нерастворимые гидроксиды металлов. Для этого в три пробироки наливают по 1 мл раствора соли, придерживаясь следующего порядка: в первую пробирку - соли железа (III); во вторую - раствор соли цинка, затем соли меди (II), кобальта, соли никеля, соли свинца соли алюминия. В каждую из пробирок добавляют по каплям разбавленный раствор щелочи (с концентрацией 0,1 моль/л) до отчетливого образования осадка. Надо помнить, которые осадки могут раствориться в избытке щелочи.
б) Затем переходят к изучению возможности образования комплексов. Для этого в каждую из пробирок добавляют по 1-2 капли концентрированного раствора щелочи.
Опыт 2. Образование амминокомплексов d- и р-металлов.
В семь пробирок наливают по 1 мл раствора соли, придерживаясь указанного выше порядка. В каждую из пробирок добавляют по 2 мл концентрированного раствора аммиака, содержимое пробирок взбалтывают.
Опыт 3. Прочность и разрушение комплексных ионов.
а) К 2 каплям раствора хлорида натрия добавить 1 каплю створа нитрата серебра.
б) К образовавшемуся осадку прилить раствор аммиака до его полного растворения.
в) К полученному раствору [Ag(NH3)2]Cl добавьте кусочек цинка. Что наблюдаете?
Запишите уравнение реакции образования комплексного аммиаката цинка. Объясните, пользуясь таблицей констант нестойкости комплексного ионов, причину вытеснения цинком серебра из его аммиачного комплексного иона. Остаток гранулы цинка вымыть и положить в склянку "отработанный цинк".
Опыт 4. Влияние разбавления на устойчивость комплексного иона.
а) Налейте в пробирку 2 капли 0,1 М раствора нитрата серебра и добавьте 1 каплю насыщенного раствора KI.
б) осадок растворите в избытке иодида калия до образования комплекса [AgI2]-.
в) Разбавьте полученный раствор водой до выпадения осадка AgI.
Дайте объяснение наблюдаемым явлениям.
Оформите протокол лабораторной работы
Образец оформления лабораторной работы. Оформление работы следует делать на развороте тетради. Описание эксперимента и наблюдения оформляют в виде таблицы. Выполнить до занятия (сделать таблицу к опыту 2 для Fe3+, продолжить на занятии). Написать в тетради для решения задач предполагаемые уравнения реакций. Уточнить после выполнения эксперимента. Наблюдения заносятся в лабораторный журнал по мере выполнения лабораторной работы. Запишите уравнения реакций в молекулярном и ионном виде ко всем опытам в соответствующих колонках.
Дата ____________ 200 г. Лабораторная работа №:7. Изучение реакций
|
комплексообразования
|
(опыт 1-2):
Катион |
1 а) цвет осадка при добавлении разбавленного раствора щелочи, уравнение реакции. |
1 б) изменения, произошедшие при добавлении концентрированного раствора щелочи, уравнение реакции. |
2) изменения, произошедшие при добавлении аммиака, уравнение реакции. |
Fe3+ |
Fe(OH)3 + NaOH(разб) =
|
|
|
Zn2+ |
|
|
|
Cu2+ |
|
|
|
Co2+ |
|
|
|
Ni2+ |
|
|
|
Pb2+ |
|
|
|
Al3+ |
|
|
|
(опыт 3-4):
№ опыта |
Реагент 1 |
Реагент 2 |
изменения, произошедшие при добавлении реагента 2, уравнение реакции. |
3 а |
AgNO3 |
NaCl
|
|
3 б |
*1
|
NH3H2O |
|
3 в |
[Ag(NH3)2]Cl |
Zn |
|
4 а |
AgNO3 |
KI |
|
4 б |
*2 |
KI |
|
4 в |
*3 |
H2O |
|
*1 - продукт опыта 3 а.
*2 - продукт опыта 4 а.
*3 - продукт опыта 4 б.
Самостоятельная работа № 5.
Строение атома и периодический закон Д.И. Менделеева.
Химическая связь. Комплексные соединения
Вариант № 0
I. Для комплексного соединения [Al(H2O)6]Cl3 составьте 1) уравнения диссоциации данного соединения в водном растворе (2 ступени), 2) запишите выражение для расчета константы нестойкости,
укажите 3) комплексообразователь и его заряд, 4) лиганды, их заряды, 5) координационное число,6) внешнюю и внутреннюю сферы, их заряды;
классифицируйте предложенный комплекс 7) по знаку заряда, 8) по природе лигандов, 9) по принадлежности к классу комплексных соединений,
10) дайте название комплексного соединения по международной номенклатуре.
II. В растворе тетрацианоцинката натрия с концентрацией 0,3 моль/л а) вычислите концентрацию иона цинка б) вычислите концентрацию иона цинка при избытке цианид ионов, равном 0,01 моль/л. К1-4 ([Zn(CN)4]2-) = 2,2.10-15.
III. Дайте название комплексного соединения Nа2[Рd(NО3)3Вr] по международной номенклатуре.
