
- •Классификация катионов и анионов.
- •Классификация катионов.
- •Классификация анионов.
- •Методы количественного анализа.
- •Метрологические характеристики количественного анализа.
- •Вычисления в количественном анализе.
- •Оборудование и посуда количественного анализа:
- •Литература:
- •Тема лекции: Гравиметрический анализ
- •Основные типы гравиметрических определений.
- •Техника выполнения гравиметрического анализа.
- •Приборы и посуда гравиметрического анализа:
- •Применение гравиметрического анализа в технохимическом контроле продукции пищевых производств и общественного питания.
- •Литература:
- •Тема лекции: Титриметрический анализ
- •Основные понятия титриметрии:
- •Закон эквивалентов. Основные величины, используемые в титриметрическом анализе.
- •Титрование, его способы.
- •Расчеты в титриметрическом анализе.
- •Примеры решения задач.
- •Классификация методов титриметрического анализа.
- •Мерная посуда титриметрического анализа.
- •Литература:
- •Тема лекции: Метод кислотно-основного титрования
- •Тема лекции: Комплексонометрия.
- •Тема лекции: Физико-химические методы анализа.
Классификация методов титриметрического анализа.
В титриметрическом анализе выделяют несколько методов в зависимости от того, на какой реакции основано определение:
1) методы кислотно-основного титрования, основанные на реакциях, связанных с процессом передачи протона:
Н+ + ОН- = Н20; СН3СООН + ОН- = СН3СОО-+ Н20; СО32- + Н+ = НСО3- ;
2) методы комплексообразования, использующие реакции образования координационных соединений (например, комплексонометрия):
Mg2+ + Н2У2- = МgУ2- + 2Н+
где Н2У2- - анион комплексона III (трилона Б)
3) методы осаждения, основанные на реакциях образования малорастворимых соединений:
Аg+ + Сl- = АgСl-↓ (аргентометрия),
Нg22+ + 2Сl- = Нg2Сl2↓ (меркурометрия);
4) методы окислительно-восстановительного титрования, основанные на окислительно-восстановительных реакциях (оксидиметрия). В зависимости от используемого стандартного раствора делится на:
метод перманганатометрии (стандартный раствор – раствор КMnO4)
МnО4- + 5Fе2+ + 8Н+ = Мn2+ + 5Fе3+ + 4Н20
метод йодометрии (стандартный раствор – раствор I2)
2S20з- + I2 = S4О62- + 2I-
метод броматометрии (стандартный раствор – раствор бромата калия КВrО3)
метод бромометрии (окисление восстановителей свободным бромом)
Мерная посуда титриметрического анализа.
При отмеривании объемов глаз экспериментатора должен находиться на одном уровне с мениском отмериваемой жидкости. Прозрачные жидкости отмеривают по нижнему краю мениска, а окрашенные, например, раствор КMnO4 – по верхнему.
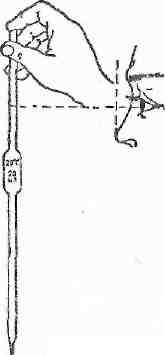
Мерная посуда для точного измерения объемов:
Мерные колбы (100 мл, 250 мл, 500 мл, 1000 мл)
Пипетки (от 1 до 100 мл – пипетки Мора с одной меткой, градуированные пипетки – 1, 2, 5, 10, 25 мл)
Бюретки (1-5 мл – микробюретки, 10-100 мл – макробюретки)
Мерная посуда для не очень точных измерений:
Мерные цилиндры
Мензурки
Мерные пробирки
Литература:
Панкратова Г.В., Жванко Ю.Н., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1980. – с. 85 – 95.
Шапиро С.А., Шапиро М.А. Аналитическая химия. – М.: Высшая школа, 1979. – с.208 – 228.
Тема лекции: Метод кислотно-основного титрования
План лекции:
1. Теоретические основы метода кислотно-основного титрования. рН.
2. Титранты метода. Индикаторы метода.
3. Кривые титрования.
4. Значение метода в технохимическом контроле продукции пищевых производств и общественного питания.
5. Гидролиз солей.
Метод кислотно-основного титрования (нейтрализации) – метод химического анализа, основанный на применении реакции взаимодействия ионов Н+ и ОН-.
Характеристика метода нейтрализации.
Уравнение реакции |
Рабочий раствор (титрант) |
Применение метода |
Фиксирование точки эквивалентности |
Недостатки метода |
Взаимодействие кислот с основаниями: Н+ + ОН- → Н2О
|
Раствор кислоты или щелочи |
Для количественного определения кислот или щелочей (жесткость воды, концентрацию солей слабых кислот – щелочная среда) |
Индикаторы (по природе – органические кислоты или основания) |
Большая трудность определения точки эквивалентности. |
В зависимости от титранта различают методы:
ацидиметрии (acidum – кислота): в качестве титранта используют 0,01 – 0,1 н. растворы сильных кислот (серная кислота, соляная кислота). Применяют для определения сильных и слабых оснований и некоторых солей слабых кислот (NaOH, NH4OH, Na2CO3, NaHCO3 и т.д.)
алкалиметрии (alkalis – щелочь): в качестве титранта используют 0,01 – 0,1 н. растворы щелочей (NaOH, KOH, Ва(ОН)2). Применяют для определения сильных и слабых кислот и некоторых солей слабых оснований (HCl, H3BO3, CH3COOH и т.д.)
Водородный показатель.
Понятие «водородный показатель» было введено датским химиком Серенсоном в 1909 г. Буква «р» - начальная буква датского слова «потенц» - степень, буква «Н» - символ водорода.
Концентрации ионов Н+ и ОН- в воде и любом водном растворе взаимосвязаны. Увеличение концентрации ионов Н+ (например, при добавлении кислоты) вызывает уменьшение концентрации ионов ОН-, и наоборот.
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными. Если концентрация ионов водорода больше, то среда в растворе кислотная, если меньше — раствор щелочной, так как концентрация гидроксид-ионов будет больше.
Кислотность растворов обычно выражают через концентрацию ионов водорода Н+. Однако выражать такими числами, как 10-8 моль/дм3 или 10-4 моль/дм3, концентрацию ионов водорода неудобно, и в химии применяют водородный показатель рН, который численно равен показателю степени молярной концентрации, взятому с обратным знаком. Например, при молярной концентрации ионов Н+, равной 10-5 моль/дм3, рН равен 5, а при концентрации ионов Н+, равной 10-8 моль/дм3, рН равен 8. Водородный показатель характеризует кислотность или щелочность раствора.
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора. При рН 7 среда раствора нейтральная. Это означает, что молярные концентрации ионов водорода Н+ и гидроксид-ионов ОН- равны.
Увеличение кислотности Увеличение щелочности
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
Величина рН играет большую роль в промышленности, химических и биологических процессах. Большинство из них может протекать только при определенной кислотности среды. На молочных комбинатах свежесть молока определяется по величине рН. В человеческом организме различные жидкости имеют различную величину рН: желудочный сок – рН 1,7 (сильнокислая среда), кровь – рН 7,4 (слабощелочная среда). Величина рН – показатель состояния здоровья человека.
Выбор титранта для кислотно-основного титрования.
Предпочтительно использовать либо сильные кислоты, либо сильные основания. В качестве индикаторов в методе нейтрализации используют слабые органические кислоты или основания.
Характеристика индикаторов метода нейтрализации:
меняют окраску в зависимости от концентрации водородных ионов в растворе
имеют интервал перехода окраски (значения рН раствора, в пределах которого индикатор меняет свою окраску)
характерен показатель титрования (концентрация ионов водорода, при которой наиболее резко меняется окраска индикатора) – рТ.
Показатель титрования основных индикаторов
рТ |
Метиловый оранжевый |
Метиловый красный |
Лакмус |
фенолфталеин |
рТ |
4 |
5 |
7 |
9 |
Требования к индикаторам в методе нейтрализации:
1. резкое отличие в окраске двух форм индикатора в небольшом интервале рН, при добавлении малого количества гидроксид-ионов или протонов Н+;
2. изменение окраски должно быть обратимо; видимая окраска индикатора наблюдается лишь внутри интервала перехода окраски.
Часто используемые индикаторы.
Столбец «х» — характер индикатора: к—кислота, о—основание.
Индикатор |
х |
Цвет более кислой формы |
Интервал перехода pH |
Цвет более щелочной формы |
фенолфталеин |
к |
бесцветный |
8,2 – 10,0 |
Малиново-красный |
Лакмус (азолитмин) |
|
красный |
5,0 – 8,0 |
синий |
Метиловый красный |
о |
красный |
4,2 – 6,2 |
Желтый |
Метиловый оранжевый |
о |
красный |
3,1 – 4,4 |
Оранжево-желтый |
Интервал перехода индикатора не является вполне точной характеристикой. Он зависит от различной интенсивности окраски обоих растворов и от различной восприимчивости глаза к разным цветам. Тем не менее, при выборе индикатора для титрования необходимо знать интервал перехода различных индикаторов. При каждом титровании следует применять определенный индикатор, который позволит свести ошибку титрования к минимуму. Информация о применении основных индикаторов в методе нейтрализации приведена в таблице.
Выбор индикаторов в методе нейтрализации
Условия титрования |
рН в момент эквивалентности |
Индикатор |
сильную кислоту титруют сильным основанием |
7 |
метиловый оранжевый, метиловый красный, фенолфталеин |
сильное основание титруют сильной кислотой |
7 |
То же |
слабую кислоту титруют сильным основанием |
больше 7 (слабощелочная) |
фенолфталеин |
Слабое основание титруют сильной кислотой |
меньше 7 (слабокислая) |
метиловый оранжевый, метиловый красный |
Для правильного выбора индикатора в методе нейтрализации строят кривые титрования.
В методе нейтрализации титрования выражают зависимость изменения рН среды от объема добавленного в процессе титрования титранта.
Кривые титрования — кривые, показывающие изменение концентраций веществ в процессе прохождения химических и электрохимических реакций титрования.
Значение:
дают возможность обнаружить, в какой мере та или иная реакция проходит количественно, т.е. можно ли ее использовать для титрования (оценка целесообразности титрования);
дают возможность установить, за изменениями какой величины лучше всего следить в ходе титрования, как эта величина изменяется и как можно обнаружить конец титрования;
дают возможность найти точку эквивалентности;
дают возможность подобрать подходящий индикатор.
На рисунках 1,2,3 представлены примеры различных случаев титрования с характерными кривыми титрования.
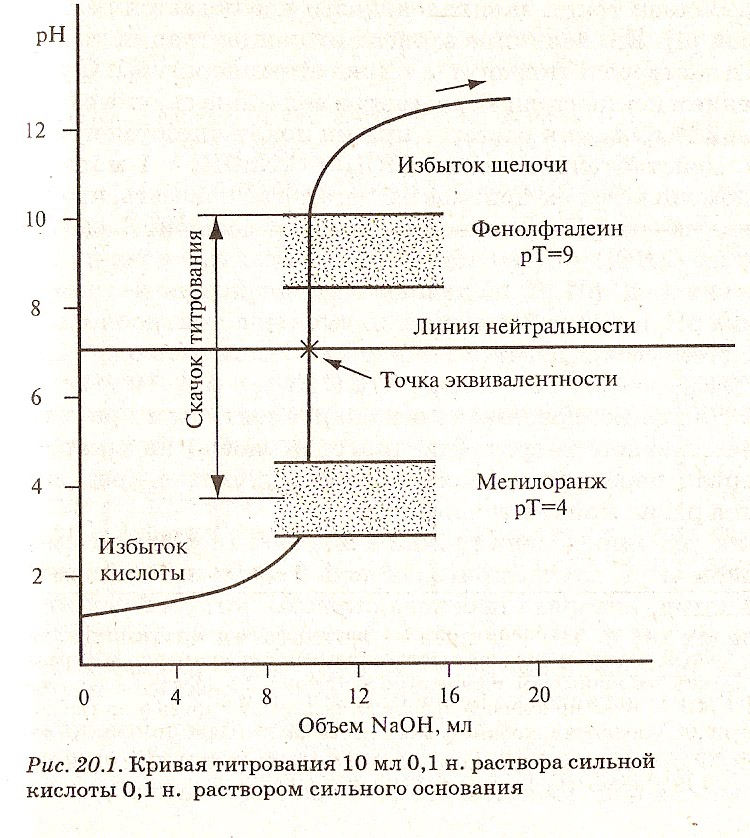
Рисунок 1. Кривая титрования раствора сильной кислоты раствором сильного основания
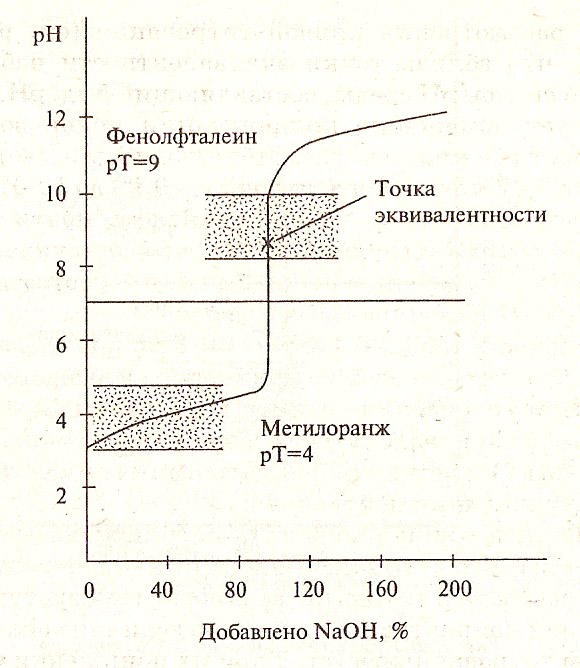
Рисунок 2. Кривая титрования слабой кислоты сильным основанием
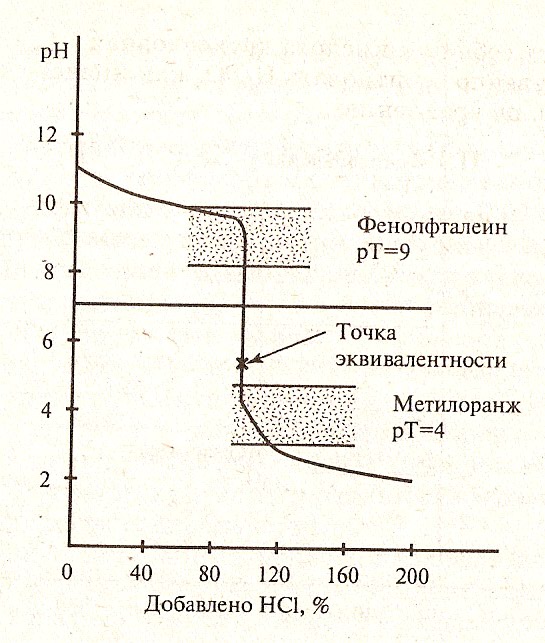
Рисунок 3. Кривая титрования слабого основания сильной кислотой
Гидролиз – взаимодействие ионов соли с ионами воды, в результате которого образуется слабый электролит.
Результат гидролиза: изменение среды раствора
Типы солей:
1. Соль, образованная сильным основанием и сильной кислотой: не гидролизуется
Примеры: КNO3, NaCl, CaCl2 и т.д.
2. Соль, образованная слабым основанием и сильной кислотой: MgSO4, CuCl2 и т.д.
MgSO4 ↔ Mg2+ + SO42- - гидролиз по катиону (анион сильной кислоты не реагирует с водой)
Mg2+ + НОН ↔ MgОН+ + Н+ - кислая среда (рН меньше 7)
MgОН+ + НОН ↔ Mg(ОН)2 + Н+ - протекает при жестких условиях
MgSO4 + 2НОН ↔ Mg(ОН)2 + Н2SO4
3. Соль, образованная сильным основанием и слабой кислотой: Na2CO3, K2SO3 и т.д.
Na2CO3 ↔ 2Na+ + CO32- - гидролиз по аниону (катион не реагирует)
CO32- + НОН ↔ НCO3- + ОН- - щелочная среда (рН больше 7)
НCO3- + НОН ↔ Н2CO3 + ОН-
Na2CO3 +2НОН ↔ Н2CO3 + 2NaOH
4. Соль, образованная слабым основанием и слабой кислотой: СН3СООNН4, Al2S3 и т.д.
СН3СООNН4 ↔ СН3СОО- + NН4+ - гидролиз по катиону и аниону
СН3СОО- + NН4+ + НОН ↔ СН3СООН + NН4ОН – среда нейтральная (рН = 7)
СН3СООNН4 + НОН ↔ СН3СООН + NН4ОН
Литература:
Панкратова Г.В., Жванко Ю.Н., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1980. – с. 95 – 104/
Шапиро С.А., Шапиро М.А. Аналитическая химия. – М.: Высшая школа, 1979. – с. 228 – 241.
Тема лекции: Методы оксидиметрии.
План лекции:
1. Сущность методов оксидиметрии (окислительно-восстановительного титрования);
2. Окислительно-восстановительный потенциал (редокс-потенциал);
3. Классификация методов оксидиметрии;
4. Характеристика отдельных методов оксидиметрии (перманганатометрия, йодометрия).
В основе ряда методов титриметрического анализа, которые объединяются под общим названием оксидиметрия, лежат окислительно-восстановительные реакции (ОВ), т.е. реакции, протекающие с изменением степени окисления атомов химических элементов, входящих в состав реагирующих веществ.
В качестве рабочих растворов (титрантов) в оксидиметрии применяют растворы окислителей и восстановителей.
Методы оксидиметрии позволяют с помощью рабочих растворов окислителей количественно определять в растворах или смесях разнообразные восстановители: соединения железа (II), олова (II), сульфиты, сульфиды, арсениты, оксалаты, пероксид водорода и др. С помощью рабочих растворов восстановителей можно определить различные окислители: дихроматы, хлор, гипохлориты, хлориты, бром, броматы, йод, йодаты, пероксид водорода и др.
К реакциям, используемым в оксидиметрии, предъявляются требования, заключающиеся в том, что реакция при титровании должна протекать быстро и необратимо с образованием продуктов строго определенного состава, не должна сопровождаться побочными взаимодействиями и должен существовать способ фиксирования конца реакции. Этим требованиям удовлетворяет лишь незначительная часть из огромного числа ОВ-реакций. Для оксидиметрического титрования подбирают ОВ пары так, чтобы разность их стандартных ОВ-потенциалов была не ниже 0,4 - 0,5 В. В противном случае при титровании отсутствует резкий скачок потенциала вблизи эквивалентной точки.
В оксидиметрии применяются различные методы определения точки эквивалентности. Например, в перманганатометрии она фиксируется по изменению окраски титруемого раствора, вызываемому избытком окрашенного рабочего раствора КМn04 (так называемое безындикаторное титрование). В йодометрии точку эквивалентности устанавливают с помощью индикатора крахмала, специфически реагирующего с йодом. В оксидиметрии применяют и специальные редокс-индикаторы (например, дифениламин), которые изменяют свою окраску в зависимости от значения окислительного потенциала, подобно тому как кислотно-основные индикаторы изменяют свою окраску в зависимости от рН раствора.
Большим недостатком окислительно-восстановительных реакций является их небольшая скорость, что затрудняет процесс титрования. Для ускорения медленно идущих реакций применяют нагревание.
Если нагревание применять нельзя (улетучивание одного из веществ, разложение и т.д.), для ускорения реакции увеличивают концентрации реагирующих веществ.
На скорость реакции может оказывать влияние введение в раствор катализатора. При титровании применяют положительные катализаторы, ускоряющие реакцию, и отрицательные катализаторы — ингибиторы, замедляющие реакцию.
Как уж было сказано, методы оксидиметрии основаны на окислительно-восстановительных реакциях, в ходе которых атомы химических элементов меняют свою степень окисления.
Степень окисления - это условный электрический заряд атома элемента в химическом соединении при условии, что все образуемые этим атомом связи являются чисто ионными. Степень окисления имеет только математический смысл и используется для нахождения стехиометрических коэффициентов реакций, классификации веществ и химической номенклатуры.
Например, реакция Cu+2S04 + Fe° = Cu° + Fe+2S04 является окислительно-восстановительной, потому что в процессе этой реакции атомы меди и железа изменяют свои степени окисления. Степень окисления атома железа повышается от О до + 2, степень окисления меди понижается от +2 до 0.
Согласно электронной теории ОВ-процессов, окисление — это процесс отдачи электронов атомом, молекулой или ионом; восстановление — это процесс присоединения электронов атомом, молекулой, ионом. При окислении степень окисления элемента повышается, при восстановлении — понижается.
Окисление всегда сопровождается восстановлением, а восстановление - окислением. Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления. Вещества, атомы, молекулы или ионы которого отдают электроны, называются восстановителями. Восстановители имеют в своем составе элементы в низшей степени окисления и в процессе реакции окисляются. К ним относятся металлы, хлороводород, йодоводород, тиосульфат натрия и др.
Вещества, атомы, молекулы или ионы которых присоединяют электроны, называются окислителями. Окислители имеют в своем составе элементы в высшей степени окисления и в процессе реакции восстанавливаются. К ним относятся азотная кислота, серная кислота, перманганат калия КМп04, оксид марганца (IV) Мn02, дихромат калия К2Сг207, йодат натрия NaI03, бромат натрия NaBr03 и др.
Число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем.
Сила окислителей и восстановителей зависит от их способности принимать или отдавать электроны: окислитель тем сильнее, чем больше у него выражена способность принимать электроны, и наоборот, более сильный восстановитель способен легче отдавать электроны.
ОВ-реакции всегда идут в сторону образования более слабых окислителей и более слабых восстановителей из исходных более сильных восстановителей и более сильных окислителей соответственно. Если в растворе содержатся несколько восстановителей, например ионы Сl-, Вг-, I-, то добавляемый окислитель КМn04 будет реагировать с самым сильным восстановителем, т.е. с йодид-ионами I-, окисляя их до свободного йода I2. То же самое можно сказать о нескольких окислителях и одном восстановителе. Восстановитель будет вначале реагировать с самым сильным окислителем.
Окислительно-восстановительный потенциал
Количественной характеристикой окислительной и восстановительной способностей различных веществ являются значения стандартных ОВ-потенциалов. При погружении электрода в раствор окислителя или восстановителя он отдает или принимает электроны. Электрод будет заряжаться положительно или отрицательно до определенного потенциала, уравновешивающего стремление электронов к перераспределению, причем положительный заряд электрода становится тем выше, чем сильнее окислительные свойства раствора. Потенциал, до которого заряжается электрод при погружении его в данный раствор, является мерой окислительной активности последнего. Его называют электродным окислительным потенциалом раствора.
Значение окислительно-восстановительного потенциала зависит от природы окислителя и восстановителя, от их концентраций и температуры. Если концентрации одинаковы, то полученные редокс-потенциалы называют стандартными и обозначают через φ°. Определение абсолютных значений окислительно-восстановительных потенциалов отдельных пар невозможно.
Они определяются экспериментально по отношению к стандартному (нормальному) водородному электроду, потенциал которого принимается за нуль при стандартных условиях (температура 25 °С, давление 1 атм, или 101,325 кПа) путем определения электродвижущей силы (э.д.с), полученного гальванического элемента (т.е. разность редокс-потенциалов обеих пар).Ряд стандартных потенциалов называется также рядом напряжений металлов. В этом ряду каждый свободный металл вытесняет из растворов солей все металлы, которые следуют за ним. Металлы, стоящие ранее водорода, вытесняют его из растворов кислот.
Значения стандартных окислительных потенциалов приводятся в справочниках.
Каждому окислителю в данных условиях соответствует определенный восстановитель: так, перманганат-иону МnО4- в кислой среде соответствует восстановитель Мn+2, в щелочной среде - Мn02; окислителю хлору Сl2 соответствует восстановитель хлорид-ион Сl-. Следовательно, каждому окислителю соответствует его окисленная форма (МnО4- ,Сl2) и восстановленная (Мn+2, Cl-1), т.е. окисленная и восстановленная формы вещества образуют сопряженную ОВ-пару.
Система, ОВ-потенциал которой больше, является окислителем по отношению к ОВ-системе, потенциал которой меньше. Отсюда, чем больше разница ОВ-потенциалов взаимодействующих частиц, тем энергичнее протекает процесс ОВ между ними.
Например, для реакции
МnО4- + 5 Fe2+ + 8Н+ = Мn2+ + 5Fe3+ + 4Н20
стандартные потенциалы имеют значение:
МnО4- + 8Н+ + 5è ↔ Мn2+ + 4Н20; Е0 = + 1,51В;
Fe3+ +1è ↔ Fe2+; Е° = + 0,77 В.
Потенциал первой системы больше, чем второй. Следовательно, окисленная форма пары МnО4-/ Мn2+ является окислителем, а восстановленная форма пары Fe3+/ Fe2+ - восстановителем.
Определение эквивалента окислителей и восстановителей
в методах оксидиметрии
В ОВ-реакциях эквивалент окислителей и восстановителей определяется по количеству электронов, отданных или принятых одной молекулой вещества в данной реакции:
Э = M : n,
где Э – молекулярная масса эквивалента, М - молекулярная масса вещества, n – число отданных или принятых электронов.
Например, в реакции между КМn04 и солью Мора (NH4)2Fe(SO4)2·6H2O
МnО4- + 5 Fe2+ + 8Н+ = Мn2+ + 5Fe3+ + 4Н20
Ион марганца принимает пять электронов, а ион железа отдает 1 электрон:
МnО4- + 8Н+ + 5è ↔ Мn2+ + 4Н20
Fe2+ - 1è ↔ Fe3+
ЭКМп04 = M : 5 = 158,04 : 5 = 31,61 г/моль
Э(NH4)2Fe(SO4)2·6H2O = М : 1 = 392,16 г/моль
Классификация методов оксидиметрии.
Все методы оксидиметрии классифицируют в зависимости от окислителя или восстановителя, применяемого в рабочем растворе, на следующие виды:
1) перманганатометрия: основным титрантом служит раствор КМn04; наряду с ним обычно используются растворы сульфата железа (II) FeS04 или щавелевой кислоты Н2С2О4;
йодометрия: титранты - растворы йода и тиосульфата натрия Na2S203;
хроматометрия: основной титрант - раствор дихромата калия К2Сг207;
броматометрия: титрант - раствор бромата калия КВг03;
Характеристика отдельных методов
окислительно-восстановительного титрования
Перманганатометрия
Метод перманганатометрии основан на реакциях окисления различных веществ перманганатом калия. Окисление восстановителей можно проводить в различных средах, причем марганец (VII) восстанавливается в кислой среде до Мn2+-ионов, в нейтральной — до марганца (IV) и в щелочной — до марганца (VI).
Расчет эквивалента перманганата калия в различных средах
Окислитель |
Среда |
Продукт реакции |
Валентность |
Число принятых электронов |
Эквивалент |
|
В окисленной форме |
В восстановленной форме |
|||||
МnО4- |
Кислая |
Мn2+ |
7 |
2 |
5 |
Э = М : 5 |
нейтральная |
Мn02 |
7 |
4 |
3 |
Э = М : 3 |
|
щелочная |
МnО42- |
7 |
6 |
1 |
Э = М |
|
Обычно окисление проводят в сильнокислой среде, в которой перманганат-ион проявляет наиболее сильные окислительные свойства. Стандартный окислительный потенциал пары Мn04 /Мn2+ составляет 1,51В, поэтому перманганат калия способен реагировать с большинством восстановителей. Продуктом восстановления КМn04 в кислой среде является почти бесцветный ион Мn2+:
Мn04 + 8Н+ + 5è → Мn2+ + 4Н20,
что очень удобно для фиксирования точки эквивалентности. При титровании розовая окраска иона Мn04 становится заметной от одной избыточной капли рабочего раствора КМn04, поэтому никакого специального индикатора не требуется. Индикатором служит сам перманганат, окрашенный в красно-фиолетовый цвет.
Для создания сильнокислой среды пользуются растворами H2S04.
Метод перманганатометрии широко применяют на практике для определения восстановителей и окислителей.
Для определения восстановителей, как правило, используют методы прямого титрования, для определения окислителей - методы обратного титрования.
Например, для определения ионов железа (II) и других восстановителей проводят прямое титрование их растворов стандартизированным раствором КМп04.
Для определения окислителей, таких, как К2Сг207 и другие, используют метод обратного титрования, суть которого заключается в том, что к раствору окислителя добавляют заведомо избыточный и точно измеренный объем рабочего раствора восстановителя, например FeS04. Затем остаток FeS04, не прореагировавший с определяемым окислителем, оттитровывают рабочим раствором КМп04.
Приготовление рабочего раствора КМn04 и его стандартизация.
Перманганат калия КМn04 содержит примеси. Среди них имеется и соединение оксид марганца (ΙV) Mn02. Это соединение катализирует реакцию окисления воды перманганатом:
4Mn04- + 2H20 = 4Mn02 + 302 + 40H-.
Кроме этого, при растворении в воде перманганат калия окисляет органические вещества, которые содержатся в дистиллированной воде. На устойчивость раствора КМn04 влияет даже свет. Все эти факторы изменяют концентрацию раствора КМn04 и вследствие этого нельзя приготовить его первичный стандартный раствор. В этом случае сначала готовят раствор КМn04 с концентрацией, приблизительно равной требуемой (обычно 0,02 или 0,05 моль/л). Раствор переливают в бутыль из темного стекла и оставляют на несколько дней до полного осаждения Мn02. После этого раствор КМn04 берут для работы с помощью сифона так, чтобы осадок Мn02 остался на дне бутылки.
В качестве исходных веществ для установки точной концентрации рабочего раствора КМn04 обычно применяют оксалат аммония (NH4)2C204•Н20, оксалат натрия Na2C204 и щавелевую кислоту Н2С20·2Н20. Наиболее удобным из этих веществ является оксалат натрия, так как он кристаллизуется без воды и не гигроскопичен.
Йодометрия
Метод йодометрии основан на ОВ-реакциях, связанных с превращением I2 в ионы I- и обратно:
I2 + 2е ↔ 21- Е0(I2/2I-) = + 0,54В
Окислитель восстановитель
Особенности йодометрии обусловлены в первую очередь хорошей обратимостью записанной полуреакции и невысоким значением стандартного окислительного потенциала пары I2/2I-. Значение окислительного потенциала этой пары характеризует йод как окислитель средней силы, а ионы I- - как восстановитель средней силы. Поэтому йодометрические методы применяются как для определения окислителей, так и для определения восстановителей.
Рабочими растворами в йодометрии являются стандартизированные растворы йода I2 (окислитель метода) и тиосульфата натрия Na2S203 (восстановитель метода). Основной титриметрической реакцией в методе является взаимодействие раствора йода и рабочего раствора тиосульфата натрия:
I2 + 2Na2S203 = 2NaI + Na2S406
Тиосульфат Тетратионат
натрия натрия
В качестве индикатора в йодометрии используется водный раствор крахмала, который образует с молекулярным йодом йодкрахмальное соединение синего цвета. При титровании восстановителей рабочим раствором йода точка эквивалентности определяется по появлению интенсивно-синего окрашивания. При титровании йода рабочим раствором тиосульфата натрия конец реакции определяется по исчезновению синей окраски от одной капли раствора тиосульфата натрия. Крахмал необходимо добавлять в самом конце титрования, когда йода в растворе становится мало и раствор приобретает соломенно-желтый цвет. Крахмал, добавленный к раствору с высокой концентрацией йода, становится черным и разрушается, что вносит ошибку в определение точки эквивалентности.
Очень высокая чувствительность крахмала к йоду и резкое изменение окраски раствора в точке эквивалентности позволяют использовать рабочие растворы меньшей концентрации, чем в других методах титриметрического анализа (от 0,01000 н. до 0,05000 н.).
Многие йодометрические реакции обратимы и протекают до конца только при создании следующих условий:
1) титрование необходимо проводить на холоде, так как, во-первых, йод - летучее соединение и, во-вторых, при нагревании чувствительность крахмала к йоду уменьшается;
2) рН раствора не должен превышать 9, так как в щелочной среде йод диспропорционирует:
I2 + 20Н- ↔ I- + IO- + Н20,
а IO-, являясь более сильным окислителем, чем I2, окисляет тиосульфат-ион до сульфат-иона:
S2032- + 20Н- + 4I0- = 2SO42- + Н20 + 4I-
Большим преимуществом йодометрического метода является доступность чувствительного и обратимого к йоду индикатора. К недостаткам относится низкая устойчивость раствора йода и неполное протекание реакций йода со многими восстановителями.
Йодометрическое определение восстановителей проводят по методу прямого или обратного титрования. Окислители определяют путем заместительного (косвенного) титрования.
При определении восстановителей методом прямого титрования рабочим раствором является раствор йода. Этим методом определяют соединения мышьяка (III), сурьмы (III), олова (II), тиосульфаты, небольшие количества H2S (например, в минеральных водах), сульфидов и сульфитов. В качестве примеров реакций, протекающих при прямом титровании восстановителей йодом, можно привести следующие:
SO32- + I2 + Н20 = SO42- + 2I- + 2Н+;
As02- + I2 + 2Н20 = HAsO42- + 2I-+ ЗН+.
В тех случаях, когда прямое титрование осложнено (например, восстановитель летучий или реакция протекает очень медленно), для определения восстановителей используют метод обратного титрования. Для этого нужны два рабочих раствора - йода и тиосульфата натрия. К определяемому восстановителю добавляют точно отмеренный объем раствора йода, взятого в избытке по отношению к восстановителю. Между йодом и восстановителем происходит реакция, затем остаток непрореагировавшего йода оттитровывается раствором тиосульфата. Например, при определении H2S:
H2S + I2 = 2I- + S + 2H+;
Избыток
I2 + 2 S2032- = 2I- + S4062-
Остаток
Этим методом определяют большие концентрации H2S, сульфидов, сульфитов, ряда металлов в порошках (например, цинка), некоторых органических соединений.
Для определения окислителей методом заместительного титрования поступают следующим образом. К подкисленному серной кислотой раствору KI, взятому в избытке, прибавляют точно отмеренный пипеткой Мора объем раствора определяемого окислителя (например, КСlO3) и выделившийся йод оттитровывают тиосульфатом натрия:
СlO3- + 6I- + 6Н+ = Сl- + 3I2 + ЗН20;
I2 + 2S2032- = 2I- + S4062-.
Число молей эквивалентов Na2S203 равно числу молей эквивалентов йода, а последнее равно числу молей эквивалентов определяемого окислителя (КСlO3). Таким образом, хотя определяемый окислитель и Na2S203 непосредственно друг с другом не реагируют, тем не менее их количества эквивалентны. Поэтому для вычисления можно пользоваться обычной формулой, применяемой при прямом титровании:
С(1/6КСlO3) • V(КСl03) = C(Na2S203) • V(Na2S203).
Этим методом определяют многие окислители, например Сl2, Вг2, КМп04, СаОС12, нитриты, Н202, соли Fe(III), Cu(II), соединения мышьяка (V).
Литература:
Панкратова Г.В., Жванко Ю.Н., Мамедова З.И. Аналитическая химия и технохимический контроль в общественном питании. – М.: Высшая школа, 1980. – с.104 – 110.
Шапиро С.А., Шапиро М.А. Аналитическая химия. – М.: Высшая школа, 1979. – с. 255 – 270.

 индикатор
индикатор