
- •Физическая химия
- •Математические понятия.
- •Тема I молекулярно-кинетическая теория трех агрегатных состояний вещества основы химической термодинамики и термохимии
- •§ 1. Агрегатное состояние вещества. Понятие о плазме.
- •§ 2. Основные газовые законы.
- •§ 3. Молекулярно-кинетическая теория газов.
- •§ 4. Газовые смеси. Закон Дальтона.
- •§ 5. Твердое агрегатное состояния.
- •§ 6. Внутреннее строение кристаллов и основные типы кристаллических решеток.
- •§ 7. Характеристика жидкого агрегатного состояния.
- •§ 8. Внутреннее трение (вязкость) жидкостей.
- •§9. Испарение и кипение жидкостей
- •§ 10. Роль воды в живых организмах.
- •§ 11. Предмет термодинамики. Основные термодинамические понятия
- •§ 12. Первое начало термодинамики
- •§ 13. Тепловые эффекты химических реакций
- •§ 14. Основные законы термохимии и термохимические расчеты
- •§ 15. Второе начало термодинамики. Понятие об энтропии.
- •§ 16. Критика теории тепловой смерти Вселенной
- •§ 17. Второе начало термодинамики и живые организмы
- •§ 18.Термодинамические потенциалы. Характеристические функции
- •§ 19. Третье начало термодинамики
- •Вопросы для самоподготовки
- •Задания к лабораторной работе 1
- •Методика калориметрических измерений
- •Время, мин
- •Тема 2.
- •§ 20. Химическая кинетика реакций. Основные положения и понятия.
- •§ 21. Классификация химических реакций.
- •§ 22. Реакции первого порядка.
- •§ 23. Реакции второго порядка.
- •§ 24. Сложные реакции.
- •§25. Влияние температуры на скорость химической реакции.
- •§ 26. Влияние температуры на скорость биологических процессов.
- •§ 27. Зависимость скорости реакции от катализатора. Катализ гомогенный и гетерогенный.
- •§ 28. Основные свойства катализаторов и факторы, влияющие на катализ.
- •§ 29.Теории гетерогенного катализа.
- •§ 30. Ферменты как катализаторы. Кинетика биохимических реакций. Уравнение Михаэлиса – Ментен.
- •§ 31. Скорость гетерогенных химических процессов.
- •§ 32. Понятие о химическом равновесии. Закон действующих масс.
- •§ 33. Смещение химического равновесия. Синтез аммиака и получение азотных удобрений.
- •§ 34. Равновесие в гетерогенных системах. Правило фаз.
- •§ 35. Применение закона действующих масс к равновесным системам «раствор — осадок». Правило произведения растворимости.
- •§ 36. Связь константы химического равновесия с максимальной работой реакции.
- •Тема 3. Фотохимия. Фотометрические методы исследования
- •§ 37. Фотохимические реакции. Корпускулярно – волновой дуализм света. Законы фотохимии
- •§ 38. Фотохимические процессы в биологических системах
- •§ 39. Фотометрические методы исследования
- •Вопросы для самоподготовки
- •Задания к лабораторной работе 3
- •Методика проведения работы 1,2
§ 6. Внутреннее строение кристаллов и основные типы кристаллических решеток.
Весьма тонкие современные методы исследования кристаллического состояния вещества подтвердили, что частицы в кристаллах (атомы, молекулы, ионы) располагаются закономерно, образуя так называемую пространственную решетку кристалла. Внешняя геометрическая форма кристалла теснейшим образом связана с его внутренней структурой. В кристаллической решетке любого тела можно выделить определенную часть, которая носит название элементарной ячейки. Она представляет собой наименьший объем кристаллической решетки вещества, который точно отражает его химический состав и все особенности внутренней структуры данного кристалла.
Во внутреннем строении кристаллов выполняется принцип плотнейшей упаковки частиц, из которых состоит данный кристалл. Под действием сил взаимного притяжения частицы стремятся разместиться как можно ближе друг к другу. Поэтому наиболее энергетически выгодно такое взаимное расположение частиц в кристалле, которое отвечает их наиболее плотной упаковке. Промежутки между ними достигают минимума. При этом могут иметь место два случая.
1.Радиусы частиц, из которых состоит кристалл, равны или очень близки по величине. Этому условию отвечают два типа кристаллических решеток: гексагональная (рис. 1.1, а) и гранецентрированная кубическая (рис. 1.1, б). В таких решетках степень заполнения объема кристалла частицами составляет 74%. Это максимально плотная упаковка частиц одинакового или близких по величине радиусов. Подобный тип решеток свойствен большинству металлов.
2.Радиусы частиц, образующих кристаллы, сильно различаются.
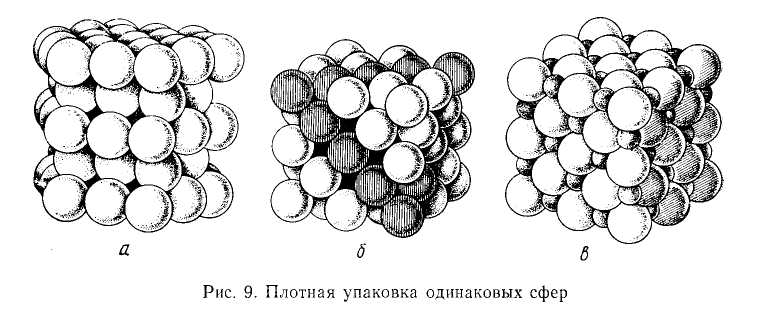
Рис. 1.1 Различные типы кристаллической решетки
Принцип плотнейшей упаковки применим и в этом случае. Частицы более крупных размеров в основном образуют кубическую или гексагональную сетку, а более мелкие частицы занимают свободное пространство между ними. Этот тип решетки характерен для ионных кристаллов, поскольку разные ионы довольно резко отличаются друг от друга по радиусам; например, такова структура кристалла хлорида натрия (рис. 1.1, в).
Следует отметить, что наряду с соотношением размеров частиц на структуру кристалла оказывают известное влияние и поляризационные взаимодействия между ними. С точки зрения структурных элементов и действующих между ними сил различают четыре типа кристаллов: молекулярные, атомные, ионные и металлические.
Молекулярная решетка. Молекулярные кристаллы имеют в углах пространственной решетки полярные или неполярные молекулы, связанные между собой силами Ван-дер-Ваальса. В качестве примера можно указать на твердую двуокись углерода (сухой лед), нафталин, лед. На рис. 1.2 показано строение элементарной ячейки твердого диоксида углерода. Как видим, атомы углерода образуют кубическую решетку с центрированными гранями: атомы кислорода расположены по обе стороны от углерода на отрезках прямых, ориентированных определенным образом относительно ребер элементарной ячейки.
Рис.
1.2 Элементарная ячейка кристалла СО2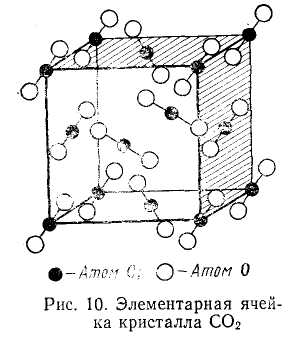
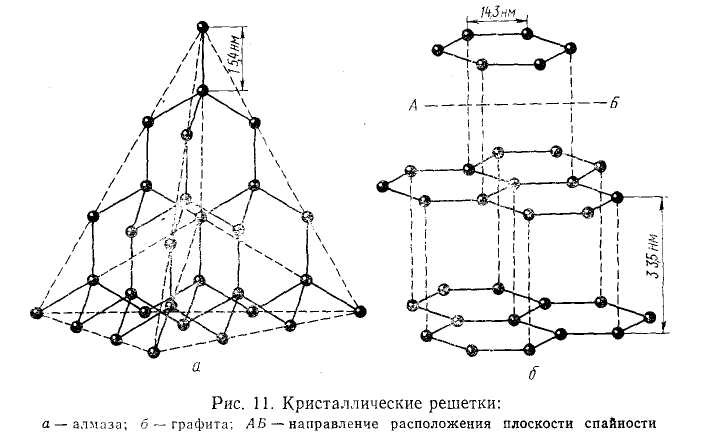
Атомная решетка. В узлах кристаллических решеток этого типа расположены нейтральные атомы, определенным образом ориентированные в пространстве и связанные ковалентными связями. К числу веществ с атомной решеткой относятся, например, кремний, графит, алмаз, бор и др. Ковалентная связь, как известно, очень прочная, поэтому все связи в кристалле равноценны и очень прочны. Вещества, образованные атомными решетками, имеют большую твердость, высокую температуру плавления, малую растворимость и малую летучесть. На рис. 1.3 приведены схемы строения атомных решеток алмаза и графита. В силу своеобразия структуры графит имеет очень малую прочность связи по плоскостям спайности кристалла, тогда как алмаз обладает огромной твердостью, поскольку все атомы углерода в его кристаллической решетке расположены друг от друга на одинаковом расстоянии.
Ионная решетка. Ионные кристаллы имеют в узлах пространственных решеток положительно и отрицательно заряженные ионы, которые связаны между собой электростатическими силами притяжения разноименных зарядов. Силы взаимодействия в ионных кристаллах весьма значительны, благодаря чему вещества с ионным типом решетки обладают высокой прочностью, высокими температурами плавления и малой летучестью.
 Ионные
решетки характерны для большинства
неорганических соединений (соли, оксиды
и другие классы соединений). Многие
минералы также имеют ионное строение.
Так, кристаллы, имеющие ионную решетку,
как правило, хорошо растворимы в воде,
а растворы их обладают высокой
электрической проводимостью. В твердом
виде ионные кристаллы не проводят
электрический ток, так как в них электроны
прочно удерживаются в атомных орбиталях
отдельных ионов. В расплавленном
состоянии кристаллические вещества
проводят электрический ток, причем
проводимость осуществляется за счет
переноса ионов. Электрическая проводимость
расплавов является характерным свойством
любых ионных структур.
Ионные
решетки характерны для большинства
неорганических соединений (соли, оксиды
и другие классы соединений). Многие
минералы также имеют ионное строение.
Так, кристаллы, имеющие ионную решетку,
как правило, хорошо растворимы в воде,
а растворы их обладают высокой
электрической проводимостью. В твердом
виде ионные кристаллы не проводят
электрический ток, так как в них электроны
прочно удерживаются в атомных орбиталях
отдельных ионов. В расплавленном
состоянии кристаллические вещества
проводят электрический ток, причем
проводимость осуществляется за счет
переноса ионов. Электрическая проводимость
расплавов является характерным свойством
любых ионных структур.
Металлическая решетка. Этот тип кристаллических решеток отличается от всех рассмотренных выше типов структур. Согласно современным представлениям, в узлах пространственной решетки типичных металлов в основном находятся положительно заряженные ионы, упакованные по принципу плотнейшей упаковки шаров, а в промежутках между ними находятся электроны в свободном состоянии. Последние образуют своеобразный «электронный газ», который как бы скрепляет одноименно заряженные ионы металла в плотнейшую кристаллическую решетку. Именно наличием свободных электронов объясняется хорошая электрическая проводимость и теплопроводность, а также многие химические свойства металлов.
Металлы, как известно, от всех известных природных материалов отличаются высокой прочностью наряду с хорошей пластичностью как в холодном, так и в горячем состоянии. Высокая температура плавления металлов указывает на значительную прочность металлической решетки и также объясняется наличием «электронного газа» в нем.
Под влиянием разности потенциалов электроны в металле начинают передвигаться в определенном направлении, что является причиной возникновения электрического тока.
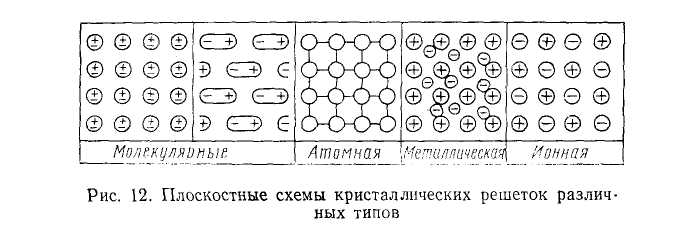
Рис. 1.4 Плоскостные схемы кристаллических решеток различных типов
На рис. 1.4 приведены плоскостные схемы всех рассмотренных типов кристаллических решеток. Однако, принимая такую классификацию кристаллов, всегда нужно иметь в виду, что характер разных связей даже в одном и том же кристалле может быть не одинаковым и классификационные признаки не всегда четко и хорошо выражены. Наряду с кристаллами, относящимися к одному из четырех рассмотренных видов связи, существуют кристаллы с различными переходными и смешанными формами связи. Это, например, целиком относится к кристаллогидратам, в которых встречаются одновременно ионный тип связи между катионами и анионами соли, ковалентная связь между атомами, входящими в состав аниона, а также полярные связи внутри молекул воды и ионодипольная связь молекул с ионами.
Значительный интерес представляют кристаллы, образующие так называемые слоистые решетки, которые характерны для графита, слюд и глинистых минералов.
Глинистые минералы, их строение, свойства и значение в почвоведении.
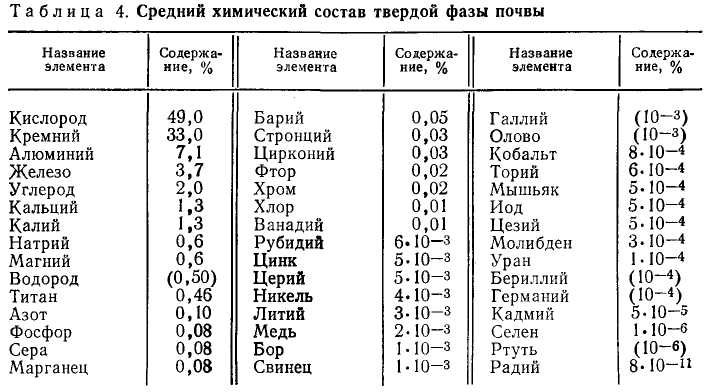
Почва более чем на девяносто процентов состоит из минеральных компонентов и содержит основной запас питательных веществ для растений. Почва является полидисперсной системой и имеет довольно сложный механический, минералогический и химический состав. В качестве примера в табл. 1.1 приведен средний химический состав твердой фазы почвы (по А. П. Виноградову).
Как видно из таблицы, почти половина твердой фазы почвы приходится на кислород, одна треть — на кремний, свыше 10% —на алюминий и железо и только 7% — на все остальные элементы. Из всех перечисленных элементов только азот (а также частично углерод, водород, кислород, фосфор и сера) содержится в органической части почвы. Все остальные элементы приходятся на минеральную часть почвы, которая состоит из большого числа различных минералов в виде частиц, имеющих размеры от 10-9 до 10-3 м и более.
Все минералы, содержащиеся в почве, по происхождению подразделяются на первичные и вторичные. Первичные минералы имеют преимущественно магматическое происхождение. Из них наиболее распространены в почвах кварц (окись кремния), полевые шпаты, амфиболы, пироксены и слюды, т. е. минералы, включающие
Таблица 1.1 Средний химический состав твердой фазы почвы
кислородные соединения кремния. Эти минералы составляют основную массу магматических и почвообразующих пород. В почвах первичные минералы обычно присутствуют в виде более или менее крупных частиц размером от 10-3 до 10-6 м, и только очень незначительная часть их имеет более высокую степень дисперсности.
Первичные минералы в условиях земной поверхности неустойчивы и под действием сил выветривания переходят в более устойчивые соединения — вторичные минералы. Процесс выветривания протекает под влиянием как чисто физических (колебания температуры, ветер, движущая сила воды), так и химических и биологических факторов. В результате этого из первичных минералов могут образоваться вторичные минералы простого состава: гидроксиды железа (II) и (III), алюминия, гидроксид кремния и некоторые другие соединения.
Кроме того, в процессе выветривания образуются также вторичные минералы более сложного строения (алюмо- и феррисиликаты). Эти последние более высокодисперсны, чем первичные, и имеют исключительно важное значение в создании основного свойства почвы — ее плодородия.
Все вторичные минералы сложного состава имеют пластинчатое строение и содержат химически связанную воду. Поскольку эти минералы являются важнейшей составной частью различных глин, они получили название глинистых или глинных минералов.
Число глинистых минералов довольно велико, но в почвах наиболее широкое распространение и значение для плодородия имеют в основном три группы минералов: каолинитовая, монтмориллонитовая и гидрослюдистая.
К минералам каолинитовой группы относятся каолинит [Al2Si2O5(OH)4] и галлуазит [Al2Si2O5(OH)4·2H2O], а также некоторые другие минералы. Каолинитовые глины содержат примерно 20—25% илистых частиц (меньше 0,001 мм), из них 5—10% частиц коллоидных размеров (меньше 0,25 микрона). Минералы этой группы довольно часто встречаются во многих типах почв. Они имеют сравнительно небольшую набухаемость и липкость.
Из минералов монтмориллонитовой группы в почвах наиболее распространены монтмориллонит [Al2Si4O10(OH)2·nH2O], бейделлит [Al2Si3O9(OH)3·nH2O], нонтронит [Fe2Si4O10(OH)3 ·nН2О] и некоторые другие. Монтмориллонитовые глины обладают в отличие от каолинитовых высокой набухаемостью, липкостью и связностью. Для них весьма характерным признаком является высокая степень дисперсности (до 80% частиц меньше 0,001 мм, из которых 40—45% меньше 0,25 микрона).
Среди глинистых минералов, встречающихся в почвах, большое место принадлежит минералам группы гидрослюд. В эту группу входят гидромусковит (иллит) {KAl2[(Si, Al)4O10](OH)2·nH2O}, гидробиотит {K(Mg, Fe)3 [(Al, Si)4O10] (OH)2·nH2O} и вермикулит {(Mg, Fe2+, Fe3+)2[(A1, Si)4O10](OH)2 ·4H2O}.
Глинистые минералы различаются по структуре.
Кристаллическая решетка различных глинистых минералов построена из одних и тех же элементарных структурных единиц, состоящих из атомов кремния и кислорода, а также из атомов алюминия, кислорода и водорода. Кроме перечисленных выше элементов в состав глинистых минералов могут входить Fe, Mg, К, Мn и др. В подавляющем большинстве глинистые минералы имеют слоистое строение и относятся к слоистым силикатам. Как показали новейшие рентгенографические и электронографические исследования, слои глинистых минералов состоят из сочетания кремнекислородных и кислород-гидроксилалюминиевых соединений.
Установлено, что важнейшие физико-химические и водно-физические свойства почвы — емкость поглощения, гидрофильность, связность, липкость, реакция среды и многие другие — находятся в прямой зависимости от минералогического состава. Теперь известно, что доступность для растений тех или иных питательных элементов в значительной мере зависит от вида минералов, содержащихся в почве, и от степени их дисперсности.
Глинистые минералы в основном сосредоточены в илистой (менее 1 мкм) фракции почв. Составом и строением минералов этой фракции в значительной степени определяется поглотительная способность почвы по отношению к катионам и анионам. Чем выше емкость поглощения почвы, тем больший запас питательных элементов в ней сосредоточен, следовательно, лучше ее потенциальное плодородие.
Минералы группы монтмориллонита обладают не только наибольшей степенью дисперсности, но и наибольшей поглотительной способностью (1,0—1,5 мкг-экв/кг). Эти минералы способны сильно набухать и содержат до 30% связанной воды, которая не может усваиваться растениями. Присутствие минералов монтмориллонитовой группы в почвах всегда положительно сказывается на растениях, обеспечивает большее содержание в них необходимых питательных элементов. Однако почвы, очень богатые монтмориллонитом, имеют невысокую агрономическую ценность. При высыхании таких почв образуются трещины, водопроницаемость их становится неодинаковой, на поверхности образуется прочная корка. Эти отрицательные свойства монтмориллонита особенно сильно проявляются на почвах, бедных гумусом. При достаточном количестве гумуса физико-химические свойства такой почвы значительно улучшаются за счет образования водопрочных органо-минеральных агрегатов. Практика показывает, что добавление в сильно деградированные песчаные почвы глин, содержащих минералы монтмориллонитовой группы, положительно сказывается на плодородии.
Минералы каолинитовой группы по своим свойствам резко отличаются от монтмориллонита. Каолинит обладает очень малой емкостью поглощения (0,07— 0,10 мкг-экв/кг); он практически не набухает и содержит весьма незначительное количество воды. Почвы, в которых много этого минерала, вследствие малой емкости поглощения отличаются низким плодородием. Сам каолинит не содержит поглощенных оснований и поэтому не является источником питания для растений. Почвы, содержащие много каолинита, хорошо отзываются на внесение в них калия и других оснований.
Минералы группы гидрослюд чрезвычайно богаты легкодоступным для растений калием (до 6—7%). Емкость поглощения гидрослюд в несколько раз выше, чем у каолинита, но в два-три раза меньше, чем у монтмориллонита. Почвы, содержащие много гидрослюдистых минералов, практически не нуждаются в калийных удобрениях.
В трудах многих ученых отмечается активное участие глинистых минералов в повышении степени доступности фосфатов почвы, калия и микроэлементов. Наличие в почвах полуторных оксидов, а также токсичного для растений подвижного алюминия обусловлено составом и строением высокодисперсных (в том числе и глинистых) минералов. Таким образом, качественный и количественный состав вторичных минералов имеет одно из первостепенных значений в создании основного свойства почвы — ее плодородия.
