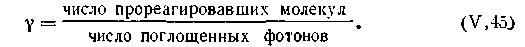- •Физическая химия
- •Математические понятия.
- •Тема I молекулярно-кинетическая теория трех агрегатных состояний вещества основы химической термодинамики и термохимии
- •§ 1. Агрегатное состояние вещества. Понятие о плазме.
- •§ 2. Основные газовые законы.
- •§ 3. Молекулярно-кинетическая теория газов.
- •§ 4. Газовые смеси. Закон Дальтона.
- •§ 5. Твердое агрегатное состояния.
- •§ 6. Внутреннее строение кристаллов и основные типы кристаллических решеток.
- •§ 7. Характеристика жидкого агрегатного состояния.
- •§ 8. Внутреннее трение (вязкость) жидкостей.
- •§9. Испарение и кипение жидкостей
- •§ 10. Роль воды в живых организмах.
- •§ 11. Предмет термодинамики. Основные термодинамические понятия
- •§ 12. Первое начало термодинамики
- •§ 13. Тепловые эффекты химических реакций
- •§ 14. Основные законы термохимии и термохимические расчеты
- •§ 15. Второе начало термодинамики. Понятие об энтропии.
- •§ 16. Критика теории тепловой смерти Вселенной
- •§ 17. Второе начало термодинамики и живые организмы
- •§ 18.Термодинамические потенциалы. Характеристические функции
- •§ 19. Третье начало термодинамики
- •Вопросы для самоподготовки
- •Задания к лабораторной работе 1
- •Методика калориметрических измерений
- •Время, мин
- •Тема 2.
- •§ 20. Химическая кинетика реакций. Основные положения и понятия.
- •§ 21. Классификация химических реакций.
- •§ 22. Реакции первого порядка.
- •§ 23. Реакции второго порядка.
- •§ 24. Сложные реакции.
- •§25. Влияние температуры на скорость химической реакции.
- •§ 26. Влияние температуры на скорость биологических процессов.
- •§ 27. Зависимость скорости реакции от катализатора. Катализ гомогенный и гетерогенный.
- •§ 28. Основные свойства катализаторов и факторы, влияющие на катализ.
- •§ 29.Теории гетерогенного катализа.
- •§ 30. Ферменты как катализаторы. Кинетика биохимических реакций. Уравнение Михаэлиса – Ментен.
- •§ 31. Скорость гетерогенных химических процессов.
- •§ 32. Понятие о химическом равновесии. Закон действующих масс.
- •§ 33. Смещение химического равновесия. Синтез аммиака и получение азотных удобрений.
- •§ 34. Равновесие в гетерогенных системах. Правило фаз.
- •§ 35. Применение закона действующих масс к равновесным системам «раствор — осадок». Правило произведения растворимости.
- •§ 36. Связь константы химического равновесия с максимальной работой реакции.
- •Тема 3. Фотохимия. Фотометрические методы исследования
- •§ 37. Фотохимические реакции. Корпускулярно – волновой дуализм света. Законы фотохимии
- •§ 38. Фотохимические процессы в биологических системах
- •§ 39. Фотометрические методы исследования
- •Вопросы для самоподготовки
- •Задания к лабораторной работе 3
- •Методика проведения работы 1,2
Тема 3. Фотохимия. Фотометрические методы исследования
§ 37. Фотохимические реакции. Корпускулярно – волновой дуализм света. Законы фотохимии
Химические реакции, протекающие под воздействием света, называются фотохимическими, а сам раздел физической химии, занимающийся их изучением, получил название фотохимии. Примеров фотохимических реакций можно привести очень много. Так, смесь газов водорода и фтора на свету взрывается, аммиак разлагается на водород и азот, бромид серебра разлагается с выделением металлического серебра, что широко используется в фотографии, процесс отбелки тканей кислородсодержащими соединениями хлора также протекает под воздействием света и т. д. К числу фотохимических процессов относятся и реакции фотосинтеза, в результате которых в зеленых растениях из оксида углерода (IV) и воды образуются различные органические соединения, главным образом углеводы.
Все фотохимические процессы подчиняются так называемому закону Гроттуса: химическое превращение вещества может быть вызвано только тем светом, который этим веществом поглощается. Отраженные веществом лучи, а также прошедшие сквозь него, не вызывают никаких химических превращений.
Опыт показывает, что количество вещества, прореагировавшего под действием поглощенного света, зависит от мощности света и от времени, в течение которого вещество было им облучено. Напомним, что мощность светового потока — это количество энергии, которую переносит световой поток через определенную площадь сечения в единицу времени. Обычно мощность выражается в Дж/с. Количественно фотохимический процесс описывает закон Тимирязева - Лазарева
|
3.01 |
где m — количество прореагировавшего вещества; ω— мощность поглощенного веществом света; t— время освещения; К — коэффициент пропорциональности, зависящий от природы происходящей фотохимической реакции. Этот коэффициент численно равен массе прореагировавшего вещества, которая приходится на единицу поглощенной световой энергии. Мощность поглощенного света имеет размерность Дж/с.
Из курса физики известно, что свет обладает двойственной природой: волновой и корпускулярной. Такие явления, как дифракция света, интерференция, свидетельствуют о его волновой природе. Явление фотоэффекта (отрыв от поверхности вещества электронов под воздействием света) дает представление о его корпускулярной природе.
Луч
света, по современным представлениям,
представляет собой электромагнитное
излучение, которое характеризуется
следующими параметрами: длиной волны
![]() ,
частотой
v,
массой и энергией фотона ε.
Возникновение его обусловлено переходом
электронов в атоме с орбиталей, более
удаленных от ядра, на орбитали,
расположенные ближе к ядру. Этот перескок
электронов сопровождается уменьшением
энергии на некоторую величину, т. е. ее
излучением. Энергия, потерянная атомом,
и есть энергия электромагнитных
колебаний. Испускание атомом
электромагнитных колебаний, так же как
и их поглощение, происходит не непрерывно,
а целыми неделимыми порциями — квантами.
Величина
кванта света или, как его еще называют,
фотона
выражается
следующим равенством:
,
частотой
v,
массой и энергией фотона ε.
Возникновение его обусловлено переходом
электронов в атоме с орбиталей, более
удаленных от ядра, на орбитали,
расположенные ближе к ядру. Этот перескок
электронов сопровождается уменьшением
энергии на некоторую величину, т. е. ее
излучением. Энергия, потерянная атомом,
и есть энергия электромагнитных
колебаний. Испускание атомом
электромагнитных колебаний, так же как
и их поглощение, происходит не непрерывно,
а целыми неделимыми порциями — квантами.
Величина
кванта света или, как его еще называют,
фотона
выражается
следующим равенством:
|
3.02 |
где ε — энергия фотона; h — коэффициент пропорциональности, называемый постоянной Планка, равный 6,62•10-34 Дж∙с; v — частота колебаний.
Кванты света — фотоны — являются материальными частицами, несущими энергию света. Каждому кванту (фотону) соответствует световая волна частоты v. Частота колебаний v связана с длиной волны соотношением
|
3.03 |
где с — скорость света, равная 3∙108 м/с. Как следует из уравнения (3.03), частота колебаний имеет размерность с-1.
Чем короче длина световой волны, т. е. чем больше ее частота, тем более мощные кванты составляют световой луч.
При попадании световой частицы в атом фотон полностью передает свою энергию атому. В ряде случаев этой энергии бывает достаточно, чтобы расколоть молекулу какого-либо вещества на отдельные атомы. При этом может произойти соответствующая перегруппировка атомов и образоваться новое химическое соединение.
Как показывает опыт, энергия обычной химической связи в большинстве случаев составляет 209,3—418,7 кДж/моль. Таким образом, на химическую реакцию может оказать влияние только излучение, имеющее энергию фотонов не ниже указанных величин. Фотоны, энергия которых лежит в пределах этого интервала, носят название фотохимических.
Между количеством лучистой энергии, поглощенной молекулами данного вещества, и количеством фотохимически прореагировавших атомов или молекул химического соединения существует определенное соотношение, выражаемое законом фотохимической эквивалентности Эйнштейна. Этот закон имеет следующую формулировку: число атомов или молекул, подвергшихся первичному фотохимическому превращению, равно числу поглощенных ими квантов света.
Для суждения о том, применим ли к данной фотохимической реакции закон Эйнштейна, пользуются понятием о квантовом выходе реакции.
Квантовым выходом реакции называется отношение числа молекул или атомов, прореагировавших в результате совокупности всех предшествующих реакций, к числу поглощенных квантов (фотонов), т. е.
|
3.04 |
Не всегда квантовый выход реакций равен единице. Объясняется это тем, что в ряде случаев вслед за собственно фотохимической реакцией происходят вторичные, так называемые темновые реакции, в результате чего на один поглощенный фотон приходится в конечном итоге не одна, а несколько молекул продукта реакции.
Наряду с реакциями, квантовый выход которых больше единицы, известны фотохимические реакции с квантовым выходом меньше единицы. Причины этого явления могут заключаться в том, что часть фотонов поглощается посторонними веществами, находящимися в смеси с реагирующими веществами. В некоторых случаях пониженный квантовый выход обусловливается обратимостью химической реакции, а также передачей энергии некоторыми молекулами, поглотившими фотоны, другим молекулам в процессе взаимных столкновений.
С точки зрения численного значения квантового выхода реакция подразделяется на те, у которых:
= 1, т.е. количество молекул и количество поглощенных квантов одинаковы – это фотоэквивалентные реакции;
< 1, в реакционной системе имеются примеси или реакция обратима;
> 1, это значит, что за первичным следуют вторичные процессы, и данная реакция чаще является фотокаталитической,
например
Cl
2
+ h![]()
2Cl
2Cl
Cl + CH 4 HCl + CH 3
CH 3 + Cl 2 Cl + CH 3Cl
и т.д.
Фотохимические реакции имеют много общего с обычными химическими реакциями. Для них, так же как и для «темновых» реакций, требуется определенное предварительное возбуждение (активация) молекул, после чего последние вступают в химическое взаимодействие. Например, реация образования озона
О2hО![]() 2О
, здесь О
-радикал кислорода,
2О
, здесь О
-радикал кислорода,
О – молекула кислорода в возбужденном состоянии.
Вторичный процесс термическая реакция происходит без непосредственного участия света:
О +О О2 , О2 + О О3 + М.
Присутствие молекул вещества М например, азота, серы и их окислов необходимо для поглощения избытка энергии, иначе молекула озона была бы неустойчивой. Эта реакция имеет большое значение для развития биологических систем нашей планеты, так как при этом поглощается большая часть жёсткого ультрафиолетового излучения.
Принципиальное отличие состоит в том, что в фотохимических реакциях молекулы возбуждаются за счет лучистой энергии, а в обычных «темновых» реакциях — за счет других источников, например нагревания.
Опыт показывает, что иногда фотохимические процессы осуществляются под действием излучения, хотя оно совершенно не поглощается реагирующими веществами. Казалось бы, в данном случае имеет место отступление от закона Гроттуса. Однако исследования показали, что эти реакции происходят только тогда, когда к реагирующим веществам примешиваются некоторые посторонние примеси, которые, поглощая световую энергию, передают ее затем реагирующим веществам. Эти примесные вещества получили название сенсибилизаторов. Механизм действия сенсибилизаторов состоит в том, что молекула сенсибилизатора при поглощении фотона переходит в возбужденное состояние, а затем, столкнувшись с молекулой реагирующего вещества, передает ей избыток своей энергии, вызывая тем самым химическое превращение. Примеров сенсибилизированных реакций можно привести очень много. Так, путем добавления к фотоэмульсии некоторых веществ, выполняющих роль сенсибилизатора, можно значительно повысить ее чувствительность к красным лучам света. Известный всем хлорофилл также является сенсибилизатором фотохимических реакций образования органических веществ в зеленых растениях.