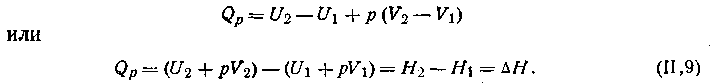- •Физическая химия
- •Математические понятия.
- •Тема I молекулярно-кинетическая теория трех агрегатных состояний вещества основы химической термодинамики и термохимии
- •§ 1. Агрегатное состояние вещества. Понятие о плазме.
- •§ 2. Основные газовые законы.
- •§ 3. Молекулярно-кинетическая теория газов.
- •§ 4. Газовые смеси. Закон Дальтона.
- •§ 5. Твердое агрегатное состояния.
- •§ 6. Внутреннее строение кристаллов и основные типы кристаллических решеток.
- •§ 7. Характеристика жидкого агрегатного состояния.
- •§ 8. Внутреннее трение (вязкость) жидкостей.
- •§9. Испарение и кипение жидкостей
- •§ 10. Роль воды в живых организмах.
- •§ 11. Предмет термодинамики. Основные термодинамические понятия
- •§ 12. Первое начало термодинамики
- •§ 13. Тепловые эффекты химических реакций
- •§ 14. Основные законы термохимии и термохимические расчеты
- •§ 15. Второе начало термодинамики. Понятие об энтропии.
- •§ 16. Критика теории тепловой смерти Вселенной
- •§ 17. Второе начало термодинамики и живые организмы
- •§ 18.Термодинамические потенциалы. Характеристические функции
- •§ 19. Третье начало термодинамики
- •Вопросы для самоподготовки
- •Задания к лабораторной работе 1
- •Методика калориметрических измерений
- •Время, мин
- •Тема 2.
- •§ 20. Химическая кинетика реакций. Основные положения и понятия.
- •§ 21. Классификация химических реакций.
- •§ 22. Реакции первого порядка.
- •§ 23. Реакции второго порядка.
- •§ 24. Сложные реакции.
- •§25. Влияние температуры на скорость химической реакции.
- •§ 26. Влияние температуры на скорость биологических процессов.
- •§ 27. Зависимость скорости реакции от катализатора. Катализ гомогенный и гетерогенный.
- •§ 28. Основные свойства катализаторов и факторы, влияющие на катализ.
- •§ 29.Теории гетерогенного катализа.
- •§ 30. Ферменты как катализаторы. Кинетика биохимических реакций. Уравнение Михаэлиса – Ментен.
- •§ 31. Скорость гетерогенных химических процессов.
- •§ 32. Понятие о химическом равновесии. Закон действующих масс.
- •§ 33. Смещение химического равновесия. Синтез аммиака и получение азотных удобрений.
- •§ 34. Равновесие в гетерогенных системах. Правило фаз.
- •§ 35. Применение закона действующих масс к равновесным системам «раствор — осадок». Правило произведения растворимости.
- •§ 36. Связь константы химического равновесия с максимальной работой реакции.
- •Тема 3. Фотохимия. Фотометрические методы исследования
- •§ 37. Фотохимические реакции. Корпускулярно – волновой дуализм света. Законы фотохимии
- •§ 38. Фотохимические процессы в биологических системах
- •§ 39. Фотометрические методы исследования
- •Вопросы для самоподготовки
- •Задания к лабораторной работе 3
- •Методика проведения работы 1,2
§ 12. Первое начало термодинамики
Первое начало (или первый закон) термодинамики и есть закон сохранения энергии. Этот закон выполняется во всех явлениях природы и подтверждается всем опытом человечества. Ни одно из его следствий не противоречит опыту. Закон сохранения энергии подтверждает положение диалектического материализма о вечности и неуничтожимости движения, поскольку энергия, по определению Энгельса, есть мера движения при его превращениях из одной формы в другую.
Термодинамика рассматривает преимущественно две формы, в виде которых совершается превращение энергии,— теплоту и работу. Поэтому первое начало термодинамики и устанавливает соотношение между тепловой энергией (Q) и работой (W) при изменении общей энергии системы (∆Q). Изменение общей энергии системы выражается уравнением (I.37).
Из постоянства запаса внутренней энергии изолированной системы непосредственно вытекает: в любом процессе изменение внутренней энергии какой-нибудь системы равно разности между количеством сообщенной системе теплоты и количеством работы, совершенной системой:
|
1.37 |
Отсюда получаем:
|
1.38 |
Это уравнение является математическим выражением первого начала термодинамики, которое в данном случае имеет следующую формулировку: подведенное к системе тепло Q идет на увеличение внутренней энергии системы ∆U и на совершение внешней работы W.
При переходе системы из одного состояния в другое внутренняя энергия в одних случаях увеличивается, в других — уменьшается. В соответствии с этим изменение внутренней энергии ∆U имеет положительный знак или отрицательный.
Первое начало термодинамики имеет несколько формулировок, однако все они выражают одну и ту же суть — неуничтожимость и эквивалентность энергии при взаимных переходах различных видов ее друг в друга.
В изолированной системе сумма всех видов энергии есть величина постоянная.
Вечный двигатель первого рода невозможен, так как невозможно создать такую машину, которая производила бы, работу без подведения энергии извне.
Система может переходить из одного состояния в другое различными путями. Но в соответствии с законом сохранения энергии изменение внутренней энергии ∆U системы не зависит от пути перехода: оно одинаково во всех случаях, если одинаковы начальное и конечное состояния системы. Количество же теплоты и количество работы W зависят от этого пути. Однако как бы ни менялись значения Q и W при разных путях перехода системы из одного состояния в другое, их алгебраическая сумма всегда одинакова, если только одинаковы начальное и конечное состояния системы.
Уравнение первого закона термодинамики (I.39) для процессов, где совершается только работа расширения, приобретает вид:
|
1.39 |
Если процесс идет при постоянном давлении (р = const), то, интегрируя, получим:
|
1.40 |
Из уравнения (1.40) видно, что теплота, поглощаемая при постоянном давлении, равна приросту энтальпии АН и не зависит от пути процесса. Из уравнения (I.40) имеем
|
1.41 |
Таким образом, энтальпию можно определять как тепловой эффект (с соответствующим знаком) процесса, протекающего при постоянном давлении.
Величиной U пользуются при исследовании изохорных процессов, протекающих при постоянном объеме системы, а величиной Н— изобарных процессов, протекающих при постоянном давлении. Следовательно, существенно различие между величинами Н и U только для газообразных систем. Для систем, содержащих вещества в жидком и твердом газообразных состояниях, величины Н и U практически одинаковы.
Следует отметить, что величины ∆Н и ∆U принято считать положительными, если в ходе процесса внутренняя энергия и энтальпия возрастают.
Обычно в таблицах термодинамических свойств веществ приводятся стандартные значения энтальпии, представляющие собой тепловые эффекты при постоянном давлении, равном 100 кПа, отнесенные к температуре 298,16 К. В химической термодинамике, как и в термохимии, оперируют такими понятиями, как энтальпия образования сложного вещества из простых веществ или энтальпия разложения веществ, энтальпия перехода из одного агрегатного состояния в другое и т. п. Изменение энтальпии ∆H химической реакции обычно определяют как разность изменения энтальпий продуктов реакции и исходных веществ:
|
1.42 |
Изменение энтальпии принято считать положительным, если тепловой эффект реакции отрицателен, т. е. если в процессе реакции теплота поглощается, и отрицательным, если тепловой эффект реакции положителен, т. е. выделяется теплота. Другими словами, изменение энтальпии АН химической реакции, протекающей при постоянном давлении, равно тепловому эффекту этой реакции, но противоположно по знаку, т. е. ∆Н= -Qp.
Первое начало термодинамики имеет огромное философское значение. Утверждая неуничтожимость энергии, оно тем самым обосновывает и неуничтожимость материи, поскольку энергия без материи существовать не может. Во всех процессах превращения материи неразрывно связаны с превращением энергии.