
- •Введение
- •Правила безопасности при работе в химической лаборатории
- •Правила проведения лабораторных работ
- •Составление отчета
- •Лабораторная работа 1 Основные классы нероганических соединений Теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Лабораторная работа 2 определение молярной массы атома металла Теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Лабораторная работа 3 определение молярной массы диоксида углерода теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Лабораторная работа 4 химическая кинетика и равновесие теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Экспериментальная часть
- •Вопросы и задачи
Экспериментальная часть
Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость изучается на примере реакции
самопроизвольного разложения тиосерной
кислоты (Н2S2О3),
получающейся в результате обменной
реакции между тиосульфатом натрия
(Na2S2О3)
и серной кислотой:
![]()
Первая реакция идет практически мгновенно. Скорость всего процесса определяется скоростью наиболее медленной, второй реакции, в результате которой выпадает сера.
Сера вначале появляется в мелкодисперсном состоянии, что обнаруживается по появлению голубоватой опалесценции, которая затем усиливается, сера выпадает в виде желтого осадка.
Время, которое проходит от начала реакции до начала помутнения раствора, определяет скорость реакции. При выполнении работы следует строго придерживаться правила: растворы реактивов отмерять предназначенными для них цилиндрами.
В три пробирки налейте по 2 мл раствора тиосульфата натрия. В три другие - серную кислоту разной концентрации. Для этого в первую пробирку налейте 6 мл раствора серной кислоты, во вторую - 4 мл раствора серной кислоты и 2 мл воды, в третью - 2 мл раствора серной кислоты и 4 мл воды. В первую пробирку с серной кислотой прилейте отмеренный объем тиосульфата натрия, закройте пробкой и перемешайте ее несколько раз. По секундомеру замерьте время, прошедшее от начала реакции до появления серы и запишите время. Секундомер включайте в момент приливания кислоты. То же проделайте с остальными растворами серной кислоты. Данные опыта запишите в табл. 3.
Таблица 3
№ |
Объем растворов, мл |
условная |
Время |
Скорость |
|||||
пробирки |
Na2S2O3 |
H2SO4 |
H2O |
концентр. H2SO4 |
до появл. осадка t, с |
реакции в усл. ед. (V=1/t) |
|||
1 |
2 |
6 |
0 |
3С |
|
|
|||
2 |
2 |
4 |
2 |
2С |
|
|
|||
3 |
2 |
2 |
4 |
1С |
|
|
|||
Зависимость скорости от концентрации реагирующих веществ выразите графически, для этого на оси абсцисс отложите условную концентрацию H2SO4 (1C, 2С, 3С), а на оси ординат - величины относительной скорости реакций, т.е. 1/t.
Сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ. Как согласуется Ваш эксперимент с законом действующих масс?
Опыт2. Зависимость скорости реакции от температуры.
В три пробирки налейте по 3 мл раствора серной кислоты, а в другие три по 3 мл раствора тиосульфата натрия. Отметьте температуру воздуха в лаборатории. Слейте вместе растворы первой пары пробирок и заметьте, через сколько секунд появится слабая опалесценция. Вторую пару пробирок поместите в химический стакан с водой, в который опустите термометр и нагрейте до температуры на 10°выше комнатной, а затем поступите так же, как с первой парой пробирок. Повторите опыт с третьей парой пробирок, нагрев их в стакане с водой до температуры на 20°выше комнатной. Запишите результаты в
табл.4.
Таблица 4
№ пробирок |
Температура опыта, °С |
Время появления серы, с |
Скорость реакции, ус. ед (V=1/t) |
Температурный коэфф. g |
1 |
Т1=Ткомн |
|
|
|
2 |
Т2=Т1+10° |
|
|
|
3 |
Т3=Т1+20° |
|
|
|
Температурный коэффициент рассчитайте по формулам:
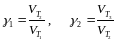 .
.
Сделайте вывод о зависимости скорости химической реакции от температуры. Как согласуются результаты опыта с правилом Вант-Гоффа?
Опыт 3. Влияние поверхности соприкосновения веществ на скорость реакции.
В сухой ступке осторожно (не растирая пестиком) смешайте несколько кристаллов нитрата свинца Pb(NO3)2 и иодида калия KI. Изменилась ли окраска веществ? Энергично разотрите кристаллы пестиком. Какого цвета стала окраска веществ? Из пипетки добавьте к смеси несколько капель воды. Что произошло? Напишите уравнение реакций и дайте объяснение опыту.
Опыт 4. Влияние катализаторов на скорость реакции.
В пробирку налейте 3 мл 10%-ного раствора пероксида (перекиси) водорода Н2О2. Отметьте, что в обычных условиях заметного разложения пероксида водорода не наблюдается. Добавьте в пробирку несколько крупинок диоксида марганца. Что произошло? Напишите уравнение реакции и объясните действие MnO2.
Опыт 5. Влияние изменение концентрации реагирующих веществ на химическое равновесие.
Классическим примером обратимой реакции является взаимодействие между хлоридом железа (III) и роданидом калия KCNS. Образующийся в результате реакции раствор роданида железа имеет красный цвет, интенсивность которого зависит от концентрации реагирующих веществ. Смещение равновесия легко наблюдать по изменению интенсивности окраски раствора.
Смешайте в пробирке по 2 мл разбавленных растворов хлорида железа (III) и роданида калия. Полученный окрашенный раствор разлейте поровну в четыре пробирки. Оставьте одну для сравнения, а в трех других измените концентрации реагирующих веществ. Для этого добавьте: в первую пробирку несколько капель концентрированного раствора хлорида железа (III) , во вторую - несколько капель концентрированного раствора роданида калия, в третью - несколько кристаллов хлорида калия. Сравните окраску трех пробирок и контрольной (первой) и сделайте вывод о смещении химического равновесия. Напишите уравнение обратимой реакции и выражение константы равновесия для этой реакции.
опыт 6. Влияние изменения температуры на химические равновесие.
В водном растворе гидроксида аммония существует равновесие:
![]() .
.
При повышении температуры равновесие реакции смещается влево (гидратация сопровождается выделением тепла).
В пробирку налейте 3-4 мл вода, добавьте 3-4 капли аммиака и 1 каплю фенолфталеина. Нагрейте пробирку в стакане в содой. Что произошло с малиновой окраской? Затем охладите пробирку водой из-под крана. Какого цвета стал раствор? Объясните наблюдаемое явление в соответствии с принципом Ле-Шателье.
