
- •Введение
- •Правила безопасности при работе в химической лаборатории
- •Правила проведения лабораторных работ
- •Составление отчета
- •Лабораторная работа 1 Основные классы нероганических соединений Теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Лабораторная работа 2 определение молярной массы атома металла Теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Лабораторная работа 3 определение молярной массы диоксида углерода теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Лабораторная работа 4 химическая кинетика и равновесие теоретическая часть
- •Экспериментальная часть
- •Вопросы и задачи
- •Экспериментальная часть
- •Вопросы и задачи
Экспериментальная часть
Опыт 1. Получение основания взаимодействием металла с водой.
Опыт выполняйте в вытяжном шкафу! Возьмите кусочек металлического натрия, промокните его фильтровальной бумагой, затем положите в фарфоровую чашечку с водой. Наблюдайте происходящую реакцию. Добавьте к образовавшемуся раствору 2-3 капли фенолфталеина. Составьте уравнение реакции и объясните изменение окраски раствора.
Опыт 2. Получение основания взаимодействием солей со щелочью.
Налейте в пробирки по 1 мл растворов солей: магния, никеля, меди, марганца, кобальта, алюминия, железа и прибавьте к ним по 3-5 капель раствора щелочи до образования осадка. Напишите уравнения реакций и укажите цвет осадков в пробирках. Пробирки с осадками сохраните для опыта 3.
Опыт 3. Получение солей взаимодействием кислот и оснований.
К основаниям, полученным в опыте 2, прибавьте по нескольку капель кислоты до растворения осадков. Напишите уравнения реакций.
Опыт 4. Определение амфотерных свойств гидроксида цинка.
К раствору соли цинка (II) добавьте несколько капель раствора щелочи до выпадения осадка гидроксида. Полученный осадок разделите на две пробирки. В первую пробирку с осадком добавьте кислоту, во вторую - щелочь до растворения осадка. Напишите молекулярные и ионные уравнения реакций и дайте определение амфотерности.
Опыт 5. Получение кислоты взаимодействием оксида с водой.
Опыт выполняйте в вытяжном шкафу! Налейте в колбу 100 мл воды и добавьте в нее 3-5 капель метилоранжа. Поместите на металлическую ложку кусочек серы и зажгите ее в пламени горелки. Ложку с горящей серой опустите в колбу, не касаясь воды и стенок. Когда колба заполнится густым белым газом, опустите ложку в воду и перемешайте. Напишите уравнение реакций и объясните изменение окраски раствора. Укажите характер оксида.
Вопросы и задачи
Назовите классы неорганических соединений и дайте их определения.
К какому классу неорганических соединений относится каждое из перечисленных веществ? Назовите их: ZnO, HgS, CaCl2, CaO, CO2, Mg(HS)2, Ca(HCO3)2, CaCO3, Ca(OH)2, Al(OH)2Cl, H3PO4, Mg(OH)2
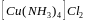 .
.Составьте формулы кислых солей H3PO4 при нейтрализации ее щелочью.
Составьте формулы основных солей Al(OH)3 и HCl.
Составьте формулы оксидов, которые можно получить, разлагая нагреванием: H2SiO3, Mg(OH)2, CaCO3, MgCO3.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: P2O5, Cu(OH)2, CaO, AgNO3, H2SO4, BaSO4? Составьте уравнения реакций.
С помощью каких реакций можно осуществить превращения:
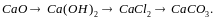
Лабораторная работа 2 определение молярной массы атома металла Теоретическая часть
Атом - это наименьшая частица элемента, сохраняющая его химические свойства при химических превращениях; система элементарных частиц, состоящая из электронов и ядра, образованного протонами и нейтронами. Совокупность атомов, обладающая одинаковым зарядом ядра, образует химический элемент. Кроме Z - заряда ядра (порядковый номер в периодической системе элементов ПСЭ), элемент характеризуется атомной массой А, валентностью В (номер группы в ПСЭ).
Атомную массу (массу одного атома) различают относительную и абсолютную. Относительная атомная масса Мr - это отношение массы данного атома к 1/12 части массы атома углерода изотопа 12 - 12С, величина безразмерная, приведена в таблице Д.И. Менделеева.
Абсолютная атомная масса Ма рассчитывается умножением относительной массы атома на фактор пересчета f=1 атомной единице массы - а.е.м. В системе СИ 1 а.е.м. = 1,661×10-27 кг. Абсолютную атомную массу Ма = Мr×f, выраженную в а.е.м., называют просто атомной массой.
Моль - это единица измерения количества вещества. 1 моль любого вещества в любом агрегатном состоянии равен количеству вещества, содержащего 6,02×1023 структурных элементов (атомов, молекул, ионов, электронов и т.д.), т.е. число Авогадро.
Массу 1 моля (М) называют молярной или мольной массой, единица измерения г/моль. Атомная масса элемента и молярная масса атомов этого элемента, содержащая 6,02×1023 атомов, численно равны, различны только единицы измерения. Например, атомная масса кислорода равна 16 а.е.м., молярная масса атомов кислорода равна
16 г/моль.
Молярную массу атома элемента можно рассчитать экспериментально, определив его молярную массу эквивалента.
Исследования соотношений, в которых элементы соединяются между собой показывают, что они соединяются строго определенными долями. Например, в молекуле HCl один атом водорода соединяется с одним атомом хлора; в молекуле H2S - 1 атом водорода соединяется с 1/2 атома серы; в молекуле NH3 1 атом водорода соединяется с
1/3 атома азота. Эти долевые соотношения взаимодействующих элементов получили название эквивалентов, что означает «равноценный или равнозначный». Эквивалент (Э) - это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентной одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент как и атом, молекула или ион безразмерен.
Молярной массой эквивалента (Мэ), или эквивалентной массой, называют массу одного моля эквивалентов (содержащего 6,02×1023 эквивалентов, единица измерения г/моль. Молярные массы эквивалентов элементов (эквивалентные массы) рассчитывают по формулам:
для простого вещества: Мэ = Ма/В;
для сложного вещества Мэ = M/В×n,
где Ма - молярная масса атомов элемента, г/моль;
М - молярная масса молекул вещества, г/моль;
В - валентность атома или функциональной группы в молекуле;
n - число функциональных групп в молекуле.
Для кислот функциональной группой
является ион водорода (![]() ),
для оснований - ион гидроксида (
),
для оснований - ион гидроксида (![]() ),
для солей - ион металла. Например, в
ионообменной реакции
),
для солей - ион металла. Например, в
ионообменной реакции
![]() участвуют 3 иона водорода. С одним ионом
водорода взаимодействуют 1 молекула
NaOH
и 1/3 молекулы H3PO4
. В результате получается 1/3
молекулы Na3PO4
и 1 молекула Н2О. Для
этой реакции эквивалентные соединения
составляют: для NaOH
Э = 1 молекула NaOH,
для H3PO4
Э = 1/3 молекулы H3PO4,
для Na3PO4
Э = 1/3 молекулы Na3PO4,
для Н2О Э = 1 молекула
Н2О. Молярные массы
эквивалентов, указанных веществ в г/моль
составляют: Мэ(NaOH)
= М/1 = 40; Мэ(H3PO4)
- М/3 = 98/3 = 32,6; Мэ(Na3PO4)
= М/3 = 164/3=54,6; Мэ(Н2О) =
М/1 = 18.
участвуют 3 иона водорода. С одним ионом
водорода взаимодействуют 1 молекула
NaOH
и 1/3 молекулы H3PO4
. В результате получается 1/3
молекулы Na3PO4
и 1 молекула Н2О. Для
этой реакции эквивалентные соединения
составляют: для NaOH
Э = 1 молекула NaOH,
для H3PO4
Э = 1/3 молекулы H3PO4,
для Na3PO4
Э = 1/3 молекулы Na3PO4,
для Н2О Э = 1 молекула
Н2О. Молярные массы
эквивалентов, указанных веществ в г/моль
составляют: Мэ(NaOH)
= М/1 = 40; Мэ(H3PO4)
- М/3 = 98/3 = 32,6; Мэ(Na3PO4)
= М/3 = 164/3=54,6; Мэ(Н2О) =
М/1 = 18.
Эквивалентным объемом (Vэ) называют объем, соответствующий эквиваленту молекулы газа. При нормальных условиях (н.у.) Т = 273К или 0°С, р = 101,03кПа или 1 атм 1 моль любого газа занимает объем 22,4 л (согласно закону Авогадро). Эквивалентный объем молекулы Н2 рассчитывается из пропорции:
2 г (молярная масса Н2) занимает объем 22,4 л
1 г (молярная масса эквивалента) занимает объем Vэ(Н2)
Решая пропорцию, получим Vэ(Н2) = (22,4×1)/2 = 11,2 л. Эквивалентный объем кислорода равен: Vэ(О2) = (22,4×8)/32 = 5,6 л,
где 8 г - молярная масса эквивалента; рассчитана Мэ=А/В;
32 г - молярная масса молекулы О2, рассчитана М=2А.
Эквивалентные соотношения взаимодействующих в реакциях веществ рассчитываются по закону эквивалентов, установленному Рихтером: «Все вещества реагируют друг с другом в эквивалентных количествах». Согласно закону, массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов:
![]() ,
,
т.е. количество молей эквивалентов,
участвующих в реакции веществ, равны
между собой. Данное соотношение
сохраняется для взаимодействующих
объемов:
![]() ;
процентов или частей (n):
;
процентов или частей (n):
![]() .
.
Экспериментально молярную массу эквивалента элемента определяют следующими методами:
Метод прямого определения - из данных синтеза кислородного или водородного соединения данного элемента. Например, окислением 0,253г металлического магния получен оксид в количестве 0,420 г.; из этих данных вычисляют молярную массу эквивалента магния, т.е. ту массу, которая соединяется с 8,0 г кислорода:
![]() .
.
Аналитический метод - это метод, при котором производят точный анализ соединения элемента с любым другим, молярная масса эквивалента которого известна. Например, рассчитать молярную массу эквивалента хлора по данным анализа хлорида серебра, содержащего 75,26% серебра и 24,74% хлора:
![]() .
.
Метод вытеснения водорода - этот метод применяют для определения молярной массы эквивалента тех металлов, которые способны вытеснить водород из разбавленных кислот и щелочей. Например, при взаимодействии 0,0936 г железа с серной кислотой выделилось при нормальных условиях 373 мл водорода. Определить молярную массу эквивалента железа. Из соотношения
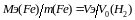 находят
находят
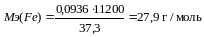 .
Молярную массу атома находят по формуле:
М = Мэ×В.
.
Молярную массу атома находят по формуле:
М = Мэ×В.
