
- •Теми лабораторних занять
- •Загальні правила виконання лабораторного практикуму
- •Надання першої допомоги
- •Хімічні реактиви, їх зберігання та робота з ними
- •Хімічний посуд
- •Посуд загального призначення
- •Посуд спеціального призначення
- •Мірний посуд
- •Нескляний посуд
- •Лабораторна робота № 2. Основні закони хімії. Визначення еквівалентної маси цинку
- •Теоретичний мінімум.
- •Хід виконання роботи
- •Обробка результату
- •Контрольні питання та завдання
- •Хід виконання роботи
- •Обробка результатів
- •Теоретичний мінімум
- •Хід виконання роботи
- •Обробка результатів
- •Дослід 2. Вивчення впливу каталізатора (інгібітору) на швидкість реакції
- •Теоретичний мінімум
- •Характерні особливрсті каталізаторів
- •Хід виконання роботи
- •1. Каталітична дія іонів купруму на швидкість окиснення калій йодиду пероксидом водню в кислому середовищі
- •2. Уповільнення взаємодії нітратної кислоти з міддю за допомогою тіосечовини.
- •Контрольні питання та завдання
- •Лабораторна робота № 4. Визначення теплового ефекту реакції нейтралізації
- •Теоретичний мінімум
- •Хід виконання роботи
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 5 Приготування розчинів певної концентрації.
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 6.
- •Слабкої кислоти
- •Теоретичний мінімум
- •Хід виконання роботи
- •Обробка результатів
- •Контрольні питання та завдання
- •Лабораторна робота № 7. Гідроліз солей
- •Теоретичний мінімум
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 8. Окисно – відновні реакції.
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 9. Вивчення методів добування неорганічних сполук різних класів та їх властивостей
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 10. Хімія елементів та їхнів сполук. Водень. Кисень. Гідроген пероксид. Методи добування та їх властивості
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 11. Хімія елементів та їх сполуки. Елементи I та II групи, головної підгрупи.
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Дослідження властивостей сульфурвмісних сполук
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 13. Хімія елементів та їх сполуки. Дослідження властивостей сполук мангану та хрому.
- •Теоретичний мінімум
- •Хід виконання роботи
- •Контрольні питання та завдання
- •Лабораторна робота № 14. Вивчення властивостей елементів підгрупи феруму. Синтез сполук феруму, кобальту, нікелю.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 15. Комплексні сполуки. Методи отримання та їх хімічні властивості
- •Теоретичний мінімум
- •Хід виконання роботи.
- •Контрольні питання та завдання
- •Лабораторна робота № 16. Твердість води. Визначення зальної твердості води комплексонометричним методом.
- •Теоретичний мінімум.
- •Хід виконання роботи.
- •Обробка результатів
- •Контрольні питання та завдання
- •Додаток
- •Рекомендована література.
Лабораторна робота № 6.
рН-метричне визначення ступеню та константи дисоціації
Слабкої кислоти
Мета роботи: навчитися з допомогою приладу вимірювати рН розчинів, обчислювати ступінь і константу дисоціації слабкого електроліту.
Матеріали і обладнання: розчини: хлоридна (HCl) та оцтова (CH3COOH) кислота 0,01 н, оцтова кислота для контрольного завдання; мірна колба об’ємом 100 мл, бюретка, хімічні стакани об’ємом 50 мл, колба-промивалка, рН-метр, фільтрувальний папір
Теоретичний мінімум
При розчиненні електролітів (солей, кислот та основ) у воді відбувається їх електролітична дисоціація – розкладання на позитивні та негативні іони.
Сильні електроліти дисоціюють незворотньо, повністю. Отже, в розчинах сильних електролітів немає молекул, а існують тільки іони.
Слабкі електроліти дисоціюють частково. Число, яке показує, яка частина розчиненого електроліту продисоціювала, називається ступенем дисоціації α. Його значення подається в частках одиниці або у відсотках і змінюється від 0 (для неелектролітів) до 1 (100%) при повній дисоціації електроліту.
Ступінь електролітичної дисоціації (α) залежить:
а) від концентрації електроліту (з ростом концентрації зменшується);
б) температури;
в) природи електролітів;
г) наявності в розчинах сторонніх іонів.
Таблиця 6.1 – Розподіл електролітів за ступенем дисоціації
Електроліти |
Слабкі α < 3 % |
Середні 3 % <α < 30 % |
Cильні α > 30 % |
Кислоти |
HCN, H2S, H2SiO3, H2CO3, HNO2, CH3COOH |
HF, H2SO3, HCOOH, H3PO4 та інші |
HNO3, H2SO4, HCI, HCIO4, HJ, HBr |
Основи |
NH4OH, нерозчинні |
Ca(OH)2↓ |
Луги-гідратні форми оксидів металів І«А» гр. і з ІІ «А»гр. Ba(OH)2, Sr(OH)2 |
Солі |
HgCl2, Hg2Cl2, нерозчинні у воді |
- |
Розчинні |
Концентрація кожного утвореного при дисоціації іона
Сіон = αnС,
де С – концентрація електроліту, n – число іонів даного типу, утворених при дисоціації однієї молекули.
Процес дисоціації слабкого електроліту оборотний. У розчині молекули та іони перебувають у рівновазі:
НА Н+ + А МеОН Ме+ + ОН,
Слабка кислота Слабка основа
де А - аніон кислотного залишку, Ме+ - катіон металу, Н+ - іон гідрогену, ОН - гідроксид іон
Константа рівноваги процесу дисоціації слабкого електроліту називається - константою дисоціації K.
[H+] [A] [M+] [OH]
Для слабкої кислоти K = , для слабкої основи K = .
[HA] [MOH]
Величина К не залежить від концентрації електроліту, а залежить тільки від природи електроліту і розчинника та від температури.
Ступінь і константа дисоціації математично зв’язані залежністю, відомою як закон розведення Оствальда:
α2
K = C.
1 – α
Для дуже слабких електролітів (α << 1) закон розведення має вигляд:
K = α2·C
Закон розведення описує дисоціацію слабких бінарних електролітів, тобто електролітів, які дисоціюють на два йони.
На основі закону Оствальда розраховують значення величин α, К та концентрації електроліту і його йонів.
Вода – дуже слабкий електроліт, який слабо дисоціює з утворенням іонів Н+ і OH- . Для характеристики процесу дисоціації води можна застосувати закон діючих мас.
Н2О ↔ Н + + ОН -,
тоді :
К(Н2О) = [Н+][ОН-] = 1∙10-14 моль/л,
або точніше:
К(Н2О) = а(Н+)∙а(ОН-) = 1∙10-14 моль/л,
де а(Н+), а(ОН-) – активності гідроген- та гідроксид- іонів.
Константа К(Н2О) називається іонним добутком або константою автоіонізації води.
Тобто в чистій воді або любому водному розчині при сталій температурі добуток концентрацій (активностей) гідроген- та гідроксид- іонів є величина стала, яка називається іонним добутком води.
Константа К(Н2О) залежить від температури: при підвищенні температури К(Н2О) зростає.
В чистій воді активності а(Н+) = а(ОН-) = 1∙10-7 моль/л:
а(Н+)
= а(ОН-)
=
![]() =
1∙10-7
=
1∙10-7
Знаючи концентрацію одного з цих іонів, завжди можна розрахувати концентрацію іншого іона. Як правило, для характеристики кислотності середовища використовують від’ємний десятковий логарифм активності (концентрації) гідроген- іонів, який називається водневим показником рН середовища.
рН = -lg а(Н+)
Нейтральне середовище рН=7, кисле - рН < 7, лужне – рН >7.(рис.32)
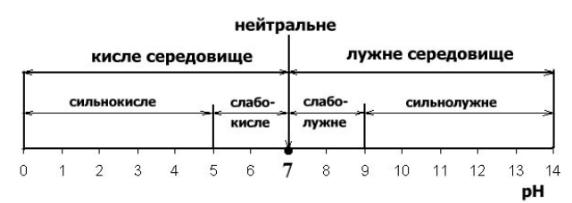
Рис.32. Воднева шкала середовища
Реакцію середовища можна характеризувати й гідроксидним показником: рОН = -lg а(ОН-), або наближено рОН = -lg [ОН-]
Тоді логарифмування виразу іонного добутку води дасть рН + рОН = 14.
Існує два основних методи визначення показника рН різноманітних розчинів:
1. Метод потенціометрії. Цей метод ґрунтується на вимірюванні потенціалів водневого, гіпгідронного та скляного електрода, які перебувають у стані рівноваги з іонами гідрогену. Для цього використовують прилади: іономери (рис.33) та рН-метри (рис.34).

Рис. 33. Іономер Рис. 34. pH – метр
2. Індикаторний метод. Визначення рН розчинів цим методом ґрунтується та тому, що індикатори змінюють своє забарвлення при різних значеннях рН.
Індикатори - це слабкі основи або кислоти (барвники органічного походження), які при зміні рН розчину змінюють свою структуру і відповідно забарвлення.
Наприклад:
Н Іnd = Н + + Іnd -
забарвлення І забарвлення ІІ
або
Іnd ОН = Іnd + + ОН -
забарвлення І забарвлення ІІ
Метиловий оранжевий
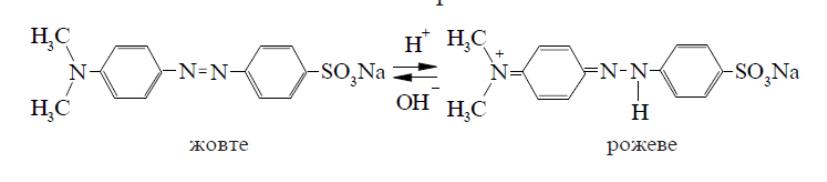
Кожний індикатор має певний інтервал рН, в якому відбувається зміна його забарвлення. Цей інтервал називається інтервалом переходу індикатора.
Якщо інтервал переходу знаходиться в межах рН<7, індикатор може використовуватися для визначення кислотного середовища (метилоранж), якщо рН>7 - для визначення лужного середовища (фенолфталеїн).
Таблиця 6.2. – Характеристика індикаторів
Назва індикатору |
Забарвлення індикатору |
Інтервал індикатора в рН |
|
Кислотна форма |
Лужна форма |
||
Метилоранж |
Рожева рН< 3,1 |
Жовта pH>4,4 |
3,1 - 4,4 |
Метил червоний |
Червона pH < 4.2 |
Жовта pH>6.2 |
4,2 – 6,2 |
Лакмус |
Червона рН<5 |
Синя pH>8 |
5,0 – 8,0 |
Фенолфталеїн |
Безбарвна рН< 8.0 |
Малинова pH>9.8 |
8,0 – 9,8 |
