
- •1.5. Основные понятия и определения химического производства
- •1.5.1. Компоненты химического производства
- •1.6. Иерархическое строение химического производства
- •1.7. Классификация химических производств
- •1.8. Показатели химического производства
- •1.8.3. Эксплуатационные показатели
- •1.8.4. Социальные показатели
- •1.9. Объемы производства основных продуктов
- •1.10. Методы химической технологии
- •1.10.1. Методические основы химической технологии как науки
- •1.10.2. Понятие о модели и моделировании
- •1,10.3. Математическое моделирование как метод изучения химических процессов и реакторов
- •1.10.4. Физическое моделирование. Место и значения эксперимента
- •1.10.5. Моделирование методом масштабного перехода на основании определенных частных соотношений (масштабирование)
- •Раздел 2 основные закономерности химической технологии
- •2.1.1. Понятие о химико-технологический процессе
- •2.1.2. Классификация хтп
- •2.1.3. Главные показатели хтп
- •2.1.4. Взаимосвязь между показателями хтп
- •2.2. Гомогенные химико-технологические процессы
- •2.2.1. Скорость гомогенных процессов
- •2.2.2,2. Влияние концентрации реагентов
- •2.2.2.3. Влияние давления
2.1.3. Главные показатели хтп
К главным показателям химико-технологического процесса относятся степень превращения (xA ) выход продукта (хR )селективность (s) и скорость реакции (ωA).
50
Степень превращения (ха) - это часть исходного реаґента, который вступил в химическую реакцию. Она определяется отношением количества (массы) реаґента (кг, кмоль и т.п.), который вступил в реакцию, к его начальному количеству (массы) (СА,0)
![]() (2.1)
(2.1)
где GА- количество (масса) реаґента не вступившего в химическую реакцию.
Для обратимых реакций используют такой показатель, как равновесная степень превращения (хА*), которая равняется отношению количества (массы) реаґента, который превратился при достижении состояния равновесия, к начальному количеству этого реаґента:
![]() (2.2)
(2.2)
где
![]() -
масса
реаґента,
который
не прореагировал, в
состоянии
равновесия.
-
масса
реаґента,
который
не прореагировал, в
состоянии
равновесия.
Выход продукта. Степень превращения характеризует эффективность осуществления процесса лишь с точки зрения использования исходного сырья. Но в случае хода параллельных или последовательных реакций часть реаґенту превращается в побочные продукты. Поэтому используют еще один показатель эффективности процесса - выход продукта, который характеризует совершенство производства с точки зрения превращения сырья в целевой продукт. Различают три вида выхода продукта: полный, равновесный и выход от теоретического.
Полный выход продукта (хR) - это отношение количества (массы) реально полученного продукта (GR) к максимально возможному (теоретическому) его количеству (массе) (GR,max). Теоретическое количество продукта рассчитывается по стехиометрическим уравнениям реакций.
(2.3)
Равновесный
выход продукта
![]() -
отношение
массы продукта, который
образовался
на момент достижения состояния
равновесия
-
отношение
массы продукта, который
образовался
на момент достижения состояния
равновесия
![]() ,
к
максимально возможной
(теоретической) массе продкта
,
к
максимально возможной
(теоретической) массе продкта
![]() (GR,max)
(GR,max)
![]() (2.4)
(2.4)
Выход
от равновесного
![]() -
отношение
массы продукта, который
реально образовался
(GR),
к
массе продукта
,
который
может образоваться
на момент достижения
состояния
равновесия
-
отношение
массы продукта, который
реально образовался
(GR),
к
массе продукта
,
который
может образоваться
на момент достижения
состояния
равновесия
![]() (2.5)
(2.5)
Если продукт образуется вследствие взаимодействия двух или более реаґентов, то можно определять выход продукта за каждому из реаґентов. В этом случае
51
выход продукта по конкретному реагенту определяется отношением массы практически полученного продукта к теоретически возможной массе, которую можно получить из этого реагента.
Для
электрохимических производств или
процессов применяют такую разновидность
указанного выше показателя, как выход
по току
(ВТ):
это отношение
массы практически
полученного продукта (GR)
к
теоретически
возможной массе
![]()
![]() (2.6)
(2.6)
Теоретически возможную массу рассчитывают по закону Фарадея
![]() (2.7)
(2.7)
где Э - эквивалентная масса вещества; I- сила тока; τ - продолжительность электролиза; F – постоянная Фарадея.
Селективность, или избирательность (s). С помощью этого показателя дается количественная характеристика использования реагента для получения целевого продукта в случае протекания параллельных или последовательных реакций, вследствие которых часть реагента расходуется на образование побочных продуктов.
Различают два вида селективности - полную (интегральную) и мгновенную (дифференциальную).
Полная (интегральная) селективность (si) — это отношение количества (массы) исходного реагента, который израсходовался на целевую реакцию, к общему количеству реагента, который прореагировал с образованием целевых и побочных продуктов:
![]() (2.8)
(2.8)
где
![]() - количество (масса) реагента
А,
который
превратился
в
целевой продукт R
- количество (масса) реагента
А,
который
превратился
в
целевой продукт R
![]() -
количество (масса) реагента
А,
который
вступил во
все химические превращения;
-
количество (масса) реагента
А,
который
вступил во
все химические превращения;
![]() -количество (масса)
реагента А,
который
превратился в
побочный продукт S.
-количество (масса)
реагента А,
который
превратился в
побочный продукт S.
Мгновенная (дифференциальная)
селективность
(![]() )-
отношение скорости
превращения
реагента в целевой продукт к
суммарной скорости превращения
этого реагента.
)-
отношение скорости
превращения
реагента в целевой продукт к
суммарной скорости превращения
этого реагента.
![]() (2.9)
(2.9)
где
![]() - скорость превращения
реагента А
в
целевой продукт R;
- скорость превращения
реагента А
в
целевой продукт R;
![]() -суммарная
скорость превращения
реагента А;
-суммарная
скорость превращения
реагента А;
![]() - скорость
превращения
реагента А
в
побочный продукт
S.
- скорость
превращения
реагента А
в
побочный продукт
S.
52
Скорость химического процесса (ωА) определяется количеством реагента, который вступил в реакцию, или образовался в результате реакции в единице объема за единицу времени
![]() (2.10) или
(2.10) или
![]() (2.11)
(2.11)
Если химический процесс происходит без изменения объема реакционной среды, то скорость реакции можно выразить через изменение концентрации реагирующих веществ во времени:
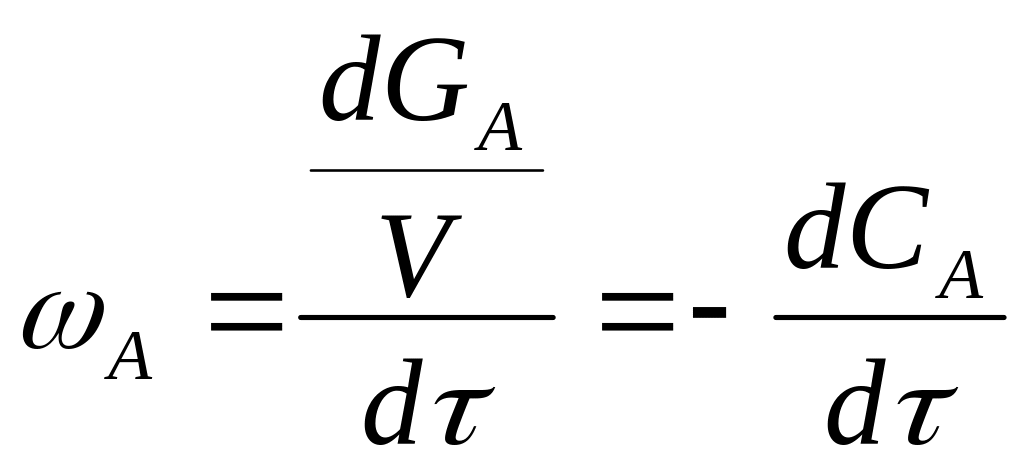 (2.12) или
(2.12) или
![]() (2.13)
(2.13)
Скорость химического процесса можно также выразить через изменение степени превращения во времени. Поскольку СА = СА,0(1 — хА ), то
![]() (2.14)
(2.14)
![]() (2.15)
(2.15)
