
- •1. Біологія – наука про життя. Предмет, завдання, методи біологічних досліджень.
- •2. Поняття про подразливість рослин. Тропізми, настії, нутації.
- •3. Фотосинтез. Характеристика етапів. Планетарне значення фотосинтезу.
- •4. Клітинне дихання. Характеристика етапів, його біологічне значення.
- •5. Мітоз - нестатевий поділ клітини. Характеристика етапів та його біологічне значення.
- •6. Мейоз - статевий поділ клітини. Характеристика етапів та його біологічне значення.
- •7. Життєвий цикл клітини. Періодизація інтерфази.
- •8. Склад, будова та функції днк.
- •9. Склад, будова та функції рнк.
- •10. Склад, будова та функції білків.
- •11. Класифікація органічних сполук. Склад, будова та функції ліпідів.
- •12. Класифікація хімічних елементів клітини. Біологічна роль води та мінеральних солей.
- •13. Ядро клітини, його будова і функції.
- •14. Загальний план будови клітини. Порівняльна характеристика клітин прокаріотів та еукаріотів.
- •15. Розвиток клітинної теорії. Сучасний стан клітинної теорії.
- •«Omnis cellula eх cellula» - Кожна клітина з клітини.
- •16. Уявлення про суть життя. Властивості живого.
- •17. Біосинтез білка: характеристика його етапів.
- •18. Склад, будова та функції вуглеводів.
- •19. Статеве розмноження організмів.
- •20. Нестатеве розмноження організмів.
- •21. Взаємозв’язок будови та функцій рослинних тканин.
- •23. Орган. Система органів. Фізіологічні та функціональні системи органів.
- •24. Неклітинні форми життя. Віруси. Їх роль у природі та житті людини.
- •Шляхи проникнення вірусів до організму людини
- •Вірусні інфекції
- •Захисні реакції організму проти вірусної інфекції. Імунітет.
- •25. Зародковий етап ембріонального розвитку.
- •26. Вікова періодизація онтогенезу людини.
- •27. Розвиток еволюційних уявлень. Докази еволюції.
- •28. Будова гамет. Порівняльна характеристика яйцеклітини та сперматозоїда.
- •29. Гаметогенез. Порівняльна характеристика овогенезу та сперматогенезу.
- •30. Початковий етап ембріонального розвитку.
- •31. Предмет і завдання генетики. Основні поняття генетики.
- •32. Методи генетичних досліджень. Особливості методів дослідження генетики людини.
- •34. Моногібридне схрещування. І, іі закони Менделя.
9. Склад, будова та функції рнк.
Молекули рибонуклеїнових кислот (РНК) мають подібну до ДНК будову, але складаються лише з одного ланцюга. Відомо три основні типи РНК: інформаційна, або матрична (іРНК, або мРНК), транспортна (тРНК) і рибосомна (рРНК). Вони розрізняються місцем розташування в клітині, формою, розмірами та функціями.
Ознаки порівняння |
ДНК |
РНК |
Особливості будови молекули |
полімер |
полімер |
Кількість ланцюгів у молекулв |
два |
один |
Мономер |
нуклеотид |
нуклеотид |
Будова мономера |
Азотиста
основа
|
Азотиста
основа |
Азотисті основи у складі мономера |
аденін (А), тимін (Т), гуанін (Г), цитозин (Г). |
аденін (А), урацил (У), гуанін (Г), цитозин (Ц). |
Реалізація принципу комплементарності |
А-Т; Г-Ц; |
А-У; Г-Ц |
Структура нуклеїнових кислот |
І,ІІ,ІІІ |
І,ІІ,ІІІ |
Ознаки для порівняння |
тРНК |
мРНК (іРНК) |
рРНК |
Вміст у % |
Близько 10% від загальної кількості РНК |
Близько 10 % від загальної кількості РНК |
До 80% від загальної кількості РНК |
Місце знаходження |
В цитоплазмі |
В цитоплазмі |
У складі рибосом |
Розміри |
70-90 нуклеотидів |
Кілька сотень-кілька тисяч нуклеотидів |
Кілька тисяч нуклеотидів |
Структури |
І, ІІ. ІІІ-у вигляді листка конюшини |
І, ІІ, ІІІ |
І,ІІ,ІІІ |
Функції |
Транспортують амінокислот до місця cинтезу білка |
Несуть інформацію про послідовність амінокислот у білку |
Складають основу рибосоми |
10. Склад, будова та функції білків.
Із органічних речовин, що входять в склад живих організмів, найбільш важливими в біологічному відношенні і найбільш складними за хімічною структурою є білки. Одне з визначень поняття «життя» так і звучить: життя – це форма існування білкових тіл.
Термін „білки” виник вперше в зв'язку із знаходженням в тканинах тварин і рослин речовин, що подібні за деякими властивостями до яєчного білка (при нагріванні вони розкладаються). Ці речовини Мульдер в 1838 р. назвав протеїнами (з грец. proteous - перший), тобто вони являються важливими складовими живої матерії, без якої неможливе життя. Нині поняття „білки” - збірне для цілого класу речовин.
При вивченні хімічної структури білків було встановлено, що основною їх структурною одиницею – мономером – являються амінокислоти. Таким чином білки – це високомолекулярні, органічні, N – вмісні біополімери, які складаються в основному з амінокислот. Загальна формула амінокислот має вигляд:
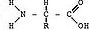


аміногрупа карбоксильна група

радикал
Наявність аміногрупи та карбоксильної групи є спільною ознакою для всіх амінокислот. Аміногрупа зумовлює основні властивості амінокислоти, карбоксильна – кислотні. Таким чином в цілому молекула амінокислоти проявляє амфотерні хімічні властивості. Радикал – у кожної амінокислоти різний і визначає індивідуальні властивості молекули.





При аналізі складу білків представників різних царств живої природи виявилось, що усі вони складаються з комбінацій 20 видів амінокислот. До сьогодні усі вони добре вивчені:





Амінокислотні ланцюжки завдовжки від двох до кількох десятків амінокислотних залишків зазвичай називають пептидами, при більшому ступені полімеризації — власне білками або протеїнами, хоча цей поділ вельми умовний. Поліпептидний ланцюг утворюється шляхом взаємодії молекул амінокислот:
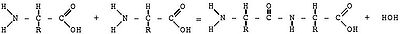

Пептидний зв’язок
Виділяють чотири рівні структури білків:
Первинна структура —послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура найбільшою мірою визначає властивості сформованого білка і є індивідуальною для кожного організму.
Вторинна структура — впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніший тип вторинної структури білків – спіраль
Третинна структура — повна просторова будова цілої білкової молекули, стабілізована водневими зв’язками, дисульфідними містками тощо. Білки що складаються з одного поліпептидного ланцюга, мають тільки третинну структуру.
Проте деякі білки побудовані з кількох ланцюгів. Для них уведено поняття четвертинної структури, що описує взаємне розташування поліпептидних ланцюгів один відносно одного.
Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах, до яких пристосований даний організм або які підтримуються в його межах в результаті збереження гомеостазу. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, приводить до втрати четвертинної, третинної і вторинної структур білка, цей процес називається денатурацією. Процес денатурації є оборотним: за умови що первинна структура молекули залишилась неушкодженою, можливе відновлення вторинної, третинної, четвертинної структур. Процес відновлення називається ренатурацією. Процес руйнування усіх структур білка, включаючи первинну має назву деструкція.
Функції білка |
Приклади |
Будівельна |
Утворюють основу цитоплазми та входять до складу усіх органел клітини. |
Каталітична |
Більшість ферментів, які каталізують хімічні реакції мають білкову природу. |
Рухова |
Будь який рух у живій природі здійснюється білковими структурами клітин. |
Транспортна |
Білок гемоглобін транспортує кисень та вуглекислий газ. Альбумін – вищі жирні кислоти тощо. |
Захисна |
Білкову природу мають чинники імунітету антитіла. Білок входить до складу шкіри, волосяного покриву ссавців. |
Регуляторна |
Ряд гормонів за своєю будовою належить до білків (інсулін, глюкагон). |
Запасна |
Білки здатні накопичуватись як запасна речовина переважно у рослин. У тварин - овоальбумін (яйцеклітини) та казеїн (молоко). |
Опорна |
Сухожилля, суглоби, кістки скелета у своєму складі містять білки. |




