
- •Сборник заданий по общей и неорганической химии для студентов I курса фармацевтического факультета
- •Способы выражения концентрации растворов Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Концентрации растворов».
- •Общие свойства растворов. Коллигативные свойства растворов Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Общие свойства растворов. Коллигативные свойства растворов»
- •Растворы электролитов. РН растворов Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Свойства растворов электролитов».
- •Реакции ионного обмена. Гидролиз Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Реакции ионного обмена. Гидролиз».
- •Буферные системы Задачи для самостоятельного решения
- •Тестовые задания
- •Химическая кинетика. Химическое равновесие Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Химическая кинетика. Химическое равновесие»
- •Окислительно-восстановительные реакции Задачи для самостоятельного решения:
- •Тестовые задания
- •Строение атома. Периодический закон. Химическая связь Задачи для самостоятельного решения
- •Комплексные соединения Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Комплексные соединения»
- •Галогены. Халькогены. Их соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Галогены. Халькогены»
- •Азот. Фосфор. Их соединения Осуществите превращения согласно схемам
- •Задачи для самостоятельного решения:
- •Тестовые задания
- •Ответы к тесту по теме «Азот. Фосфор»
- •Углерод, кремний и их соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Углерод, кремний и их соединения»
- •Бор, алюминий и их соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Бор, алюминий и их соединения»
- •Медь, цинк и их соединения Медь и ее соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Цинк и его соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Щелочные и щелочноземельные металлы и их соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Щелочные и щелочноземельные металлы и их соединения»
- •Хром и его соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Хром и его соединения».
- •Марганец и его соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Железо, кобальт, никель. Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Железо, кобальт, никель».
- •Литература
Ответы к тесту по теме «Хром и его соединения».
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Ответ |
4 |
4 |
1 |
3 |
2 |
1 |
2 |
1 |
1 |
3 |
№ |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
Ответ |
3 |
3 |
4 |
3 |
2 |
2 |
3 |
1 |
3 |
2 |
Марганец и его соединения Осуществите превращения
1. Mn → MnCl2 → Mn(OH)2 → MnSO4
2. Mn → Mn(NO3)2 → HMnO4 → MnO2 → MnCl2 → Mn(OH)2 → MnSO4
3. Восстановитель + KMnO4 (кислая среда) → Марганец (II) – Mn2+
4. Восстановитель + KMnO4 (нейтральная среда) → Марганец (IV) – MnO2
5. Восстановитель + KMnO4 (щелочная среда) → Марганец (VI) – MnO42-
6. Пиролюзит (MnO2) → Mn(металлический) → KMnO4
7. Напишите уравнения реакций, в которых степень окисления марганца
изменяется в соответствии со схемой:
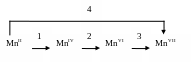
8. Напишите уравнения реакций, в которых степень окисления марганца
изменяется в соответствии со схемой:

9. Напишите уравнения реакций, в которых степень окисления марганца
изменяется в соответствии со схемой:

10. Напишите уравнения реакций, в которых степень окисления марганца
изменяется в соответствии со схемой:

Задачи для самостоятельного решения
Рассчитайте массу технического кремния (массовая доля Si - 98%), который требуется для восстановления 82.3 кг концентрата, если массовая доля Mn2O3 в нем составляет 96%.
Ответ: 21.4 кг.
Как изменяются свойства оксидов и гидроксидов d-элементов VII группы с увеличением степени их окисления? Устойчив ли белый осадок Mn(OH)2 во влажном состоянии к действию кислорода воздуха? Можно ли это обнаружить по какому-то внешнему признаку?
Ответ: усиливаются кислотные свойства и окислительная способность. Нет, в результате получается соединение переменного состава бурого цвета (Mn(OH)4), общей формулой MnO2.xH2O.
Окислительно-восстановительные потенциалы систем
MnO2 + 2H2O = MnO4- + 4H+ + 3e
ReO2 + 2H2O = ReO4- + 4H+ + 3e
соответственно равны 1.69В и 0.51В. Можно ли окислить MnO2 и ReO2 хлором по схемам:
MnO2 + H2O + Cl2 = HMnO4 + HCl
ReO2 + H2O + Cl2 = HReO4 + HCl
Ответ: нет.
На какие продукты разлагается благодаря своей непрочности марганцовистая кислота H2MnO4?
Ответ: MnO2, H2O, O2.
Чему равна масса KMnO4, содержащегося в растворе объемом 100мл, если С(KMnO4)=0.1 моль/л?
Ответ: 1.58 г.
Найдите молярную концентрацию эквивалента для раствора перманганата калия по следующим данным: 20мл раствора KMnO4 затрачено на титрование раствора щавелевой кислоты, взятого объемом 25мл. Раствор кислоты был предварительно приготовлен в мерной колбе на 100мл из навески H2C2O4.2H2O массой 0.0630 г.
Ответ: 0.0125 моль/л.
Какие ферменты содержит в своем составе марганец?
Ответ: аргиназа, холинэстераза, фосфоглюкомутаза, пируваткарбоксилаза.
Наиболее широко используемыми в медицине соединениями марганца являются?
Ответ: KMnO4, MnSO4, MnCl2.
Окисление сульфита натрия перманганатом калия в нейтральной среде изображают следующим уравнением:
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
Написать это уравнение в ионной форме и вычислить, сколько граммов сульфита натрия окисляется необходимым количеством перманганата калия, если образуется 42.6 г сульфата натрия.
Ответ: 37.8 г.
Сколько граммов FeSО4.7H2O можно окислить в сернокислом растворе при действии 40 мл 0.12н. раствора KMnO4?
Ответ: 1.334 г.
