
- •Сборник заданий по общей и неорганической химии для студентов I курса фармацевтического факультета
- •Способы выражения концентрации растворов Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Концентрации растворов».
- •Общие свойства растворов. Коллигативные свойства растворов Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Общие свойства растворов. Коллигативные свойства растворов»
- •Растворы электролитов. РН растворов Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Свойства растворов электролитов».
- •Реакции ионного обмена. Гидролиз Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Реакции ионного обмена. Гидролиз».
- •Буферные системы Задачи для самостоятельного решения
- •Тестовые задания
- •Химическая кинетика. Химическое равновесие Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Химическая кинетика. Химическое равновесие»
- •Окислительно-восстановительные реакции Задачи для самостоятельного решения:
- •Тестовые задания
- •Строение атома. Периодический закон. Химическая связь Задачи для самостоятельного решения
- •Комплексные соединения Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Комплексные соединения»
- •Галогены. Халькогены. Их соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Галогены. Халькогены»
- •Азот. Фосфор. Их соединения Осуществите превращения согласно схемам
- •Задачи для самостоятельного решения:
- •Тестовые задания
- •Ответы к тесту по теме «Азот. Фосфор»
- •Углерод, кремний и их соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Углерод, кремний и их соединения»
- •Бор, алюминий и их соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Бор, алюминий и их соединения»
- •Медь, цинк и их соединения Медь и ее соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Цинк и его соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Щелочные и щелочноземельные металлы и их соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Щелочные и щелочноземельные металлы и их соединения»
- •Хром и его соединения Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Хром и его соединения».
- •Марганец и его соединения Осуществите превращения
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Железо, кобальт, никель. Осуществите превращения:
- •Задачи для самостоятельного решения
- •Тестовые задания
- •Ответы к тесту по теме «Железо, кобальт, никель».
- •Литература
Тестовые задания
Выберите один правильный ответ
Что изучает химическая кинетика?
Изучает возможность и направление химических реакций.
Изучает скорость и механизм химических реакций, и зависимость их от различных факторов.
Тепловой эффект химической реакции.
Изменение энтропии и энтальпии химических реакций от времени.
Для какой из реакций записано кинетическое уравнение скорости реакции v = kC2ACB:
1. А2(г) + В(г) С(г) 2. 2А(г) + В(тв) С(г)
3. А2(тв) + В(г) С(г) 4. 2А(г) + В(г) С(г)
Как изменится скорость реакции при повышении температуры на 20, если температурный коэффициент скорости реакции равен 3?
1. Увеличится в 3 раза. 2. Увеличится в 6 раз.
3. Увеличится в 9 раз. 4. Увеличится в 60 раз.
Что такое молекулярность химической реакции?
Обще число молекул в единице объема.
Число молекул продуктов реакции.
Общее число молекул исходных веществ и продуктов реакции.
Число молекул, участвующих в элементарном акте реакции.
Для какой реакции справедливо утверждение, что скорость реакции – это изменение концентрации вещества в единицу времени:
Для любой реакции. 2. Для гетерогенной реакции.
3. Для обратимой реакции. 4. Для гомогенной реакции.
6. В чем заключается сущность действия катализатора?
Катализатор повышает энергию активации реакции.
Катализатор с реагирующими веществами образует неустойчивые промежуточные соединения, при этом энергия активации понижается.
Катализатор уменьшает долю активных частиц в реакционной смеси.
4. Катализатор смещает химическое равновесие и увеличивает выход продукта обратимой реакции.
7. Укажите единицы измерения скорости гетерогенной реакции
1. моль/(м2с). 2. моль/(лс).
3. л/(смоль). 4. л2/(смоль2).
8. Каков физический смысл константы скорости реакции?
Константа скорости реакции есть скорость реакции при постоянных концентрациях реагирующих веществ.
Характеризует зависимость скорости реакции от температуры.
Константа скорости есть скорость реакции при концентрации реагирующих веществ, равных единице.
Характеризует состояние химического равновесия.
9. Константа химического равновесия для реакции 2NO + O2 2NO2 имеет вид:
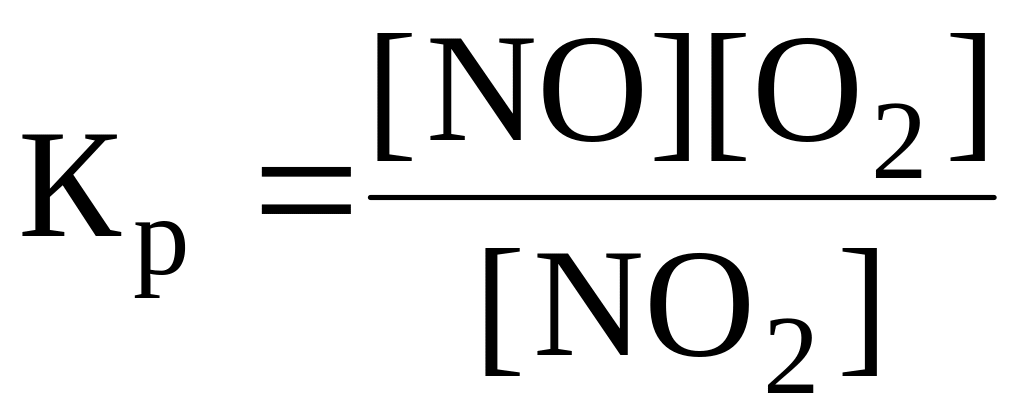 .
2.
.
2.
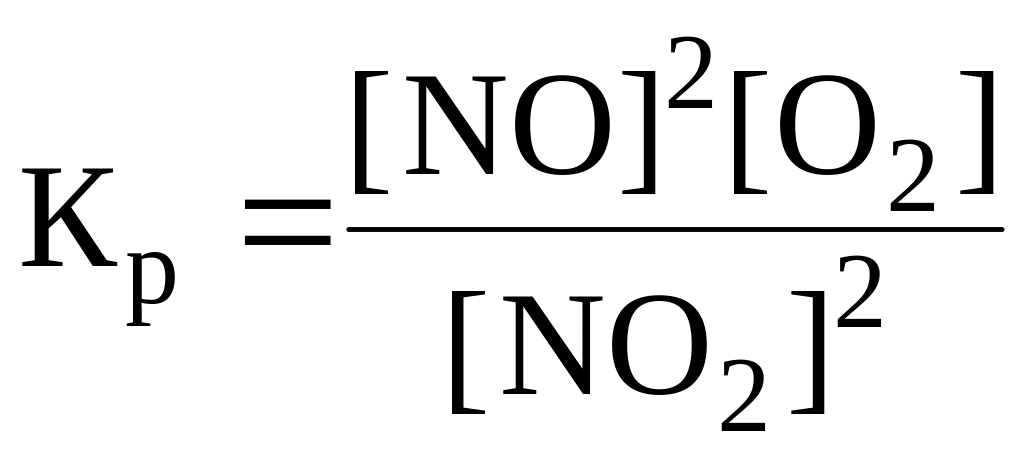 .
.
3.
 .
4.
.
4.
![]() .
.
10. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
СО2(г) + С(т) 2СО2(г) + Q.
I2(г) + 5CO2(г) I2O5(т) + 5CO(г) – Q.
N2(г) + O2(г) 2NO(г) – Q.
C2H2(г) + 2H2(г) C2H6(г) + Q.
Ответы к тесту по теме «Химическая кинетика. Химическое равновесие»
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Ответ |
2 |
4 |
3 |
4 |
4 |
2 |
1 |
3 |
3 |
4 |
