
- •Правила оформлення звітів лабораторних робіт
- •Заняття 1 Основи техніки безпеки при виконанні лабораторних робіт
- •Заняття 2 Основні поняття хімії. Будова атома. Періодичний закон та періодична система хімічних елементів Програмні питання:
- •Зразок картки контролю знань
- •Тест самоконтролю №1
- •Відповіді
- •Тест самоконтролю №2
- •Відповіді
- •Заняття 3 Оксиди. Гідрати оксидів Програмні питання
- •Короткі теоретичні відомості
- •Класифікація оксидів
- •Хімічні властивості основних оксидів
- •Хімічні властивості кислотних оксидів
- •Хімічні властивості амфотерних оксидів
- •Хімічні властивості гідратів оксидів
- •Зразок картки контролю знань
- •Завдання для самостійної роботи
- •Тест самоконтролю №1
- •Відповіді
- •Тест самоконтролю №2
- •Відповіді
- •Хід роботи
- •1 Кислотні оксиди
- •2 Основні оксиди
- •3 Амфотерні оксиди
- •4 Одержання та властивості малорозчинних у воді основ та амфотерних гідратів оксидів
- •Заняття 4 Солі. Координаційні (комплексні) сполуки Програмні питання
- •Короткі теоретичні відомості
- •Хімічні властивості солей
- •Координаційні (комплексні) сполуки
- •Зразок картки контролю знань
- •Завдання для самостійної роботи
- •Завдання для самостійної роботи
- •Тест самоконтролю №1
- •Відповіді
- •Тест самоконтролю №2
- •Відповіді
- •Хід роботи
- •1 Кислі солі
- •2 Основні солі
- •3 Координаційні (комплексні) сполуки
- •Заняття 5 Модуль 1
- •Відповіді для самоперевірки (Модуль 1)
- •Заняття 6 Окисно-відновні реакції Програмні питання
- •Короткі теоретичні відомості
- •Зразок картки контролю знань
- •Завдання для самостійної роботи
- •Тест самоконтролю №1
- •Відповіді
- •Тест самоконтролю №2
- •Відповіді
- •Хід роботи
- •1 Окисні властивості калій перманганату в кислому середовищі
- •2 Окисні властивості калій дихромату
- •3 Відновлення перманганату калію в залежності від середовища
- •Заняття 7 Розчини. Гідроліз солей Програмні питання
- •Короткі теоретичні відомості
- •1 Гідроліз солей іі типу
- •2 Гідроліз солей ііі типу
- •3 Гідроліз солей іv типу
- •Зразок картки контролю знань
- •Завдання для самостійної роботи
- •Тест самоконтролю №1
- •Відповіді
- •Тест самоконтролю №2
- •Відповіді
- •Хід роботи.
- •1 Гідроліз солей. Визначення pH середовища за допомогою універсального індикатора
- •2 Вплив температури на гідроліз
- •Заняття 8 Взаємодія металів з кислотами. Основи електрохімії Програмні питання
- •Короткі теоретичні відомості
- •Електродні потенціали. Гальванічний елемент
- •Електроліз
- •1 Електроліз розплавів
- •2 Водні розчини солей.
- •Катодні процеси
- •Анодні процеси
- •Зразок картки контролю знань
- •Завдання для самостійної роботи
- •Тест самоконтролю №1
- •Відповіді
- •Тест самоконтролю №2
- •Відповіді
- •Хід роботи
- •1 Взаємодія міді з кислотами
- •2 Взаємодія цинку з кислотами
- •3 Гальванічний елемент
- •4 Електроліз водного розчину натрій хлориду
- •Заняття 9 Модуль 2
- •Відповіді для самоперевірки Модуля 2
- •Рекомендовані для теоретичної підготовки студентів джерела Основні
- •Додаткові
- •Перелік використаних джерел
3 Гідроліз солей іv типу
Гідроліз солей ІV типу проходить в одну стадію незалежно від заряду катіону чи аніону.
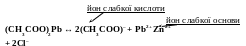
(CH3COO)2Pb + 2H2O = 2CH3COOH + Pb(OH)2,
2(CH3COO)– + Pb2+ + 2H2O = 2CH3COOH + Pb(OH)2.
Гідроліз солей цього типу проходить повністю або майже повністю і записується в одну стадію, незалежно від кислотності слабкої основи чи основності слабкої кислоти. Середовище можна вважати близьким до нейтрального (рН ≈ 7).
Зразок картки контролю знань
1 Скільки мілілітрів 20% розчину К2SO3, густина якого 1,3 г/см3 необхідно взяти для приготування 2 л 2,6M р-ну?
2 Напишіть рівняння реакцій ступінчатої дисоціації H3PO4. Для кожного ступеню напишіть вираз для константи дисоціації.
3 Визначте рН розчину, в якому концентрація йонів ОН- дорівнює 1,67´10-13 моль/л.
4 Які з цих солей піддаються гідролізу:
CuSO4, Ba(NO3)2, K2Se, NaClO4 ?
Складіть для них молекулярні, повні та скорочені йонні рівняння реакцій гідролізу.
Для кожного випадку вкажіть реакцію середовища (кисле, лужне, приблизно нейтральне) та рН (більше, менше чи приблизно рівне 7).
Завдання для самостійної роботи
Завдання І
1 У воді масою 200 г розчинили калій гідроксид масою 11,2г. Густина одержаного розчину 1,04 г/см3. Обчисліть молярну концентрацію цього розчину.
2 Скільки грамів магній сульфату необхідно для приготування 200 мл 0,2 М розчину?
3 Визначіть молярну концентрацію розчину, 650 мл якого містить 5,6 г калій гідроксиду.
4 Яка маса HNO3 в 2 л її 0,1н розчину?
5 Визначіть молярну концентрацію розчину сульфатної кислоти з масовою часткою 44 %, густина якого 1,34 г/см3.
6 Обчисліть масу калій хлориду, необхідного для приготування розчину цієї солі об’ємом 300 мл, молярна концентрація якого становить 0,15 М.
7 Який об’єм 2 н нітратної кислоти можна приготувати з 50 л 100%-ної нітратної кислоти густиною 1,51 г/см3?
8 Обчисліть об’єм 5 М розчину КОН, необхідного для приготування 0,6 М розчину об’ємом 250 мл.
9 Густина 26%-го розчину КОН рівна 1,24 г/см3. Визначіть молярну концентрацію розчину.
10 Скільки мілілітрів 0,5 М розчину барій хлориду можна приготувати із 24,4 г BaCl2 . 2H2O?
11 Визначіть молярну концентрацію еквівалентів розчину алюміній сульфату, якщо у 200 мл його міститься сіль масою 11,4г.
12 Скільки грамів H3PO4 необхідно для приготування 100 мл 0,02 н розчину?
13 Визначіть молярну концентрацію розчину сульфатної кислоти з масовою часткою 10 %, густина якого 1,07 г/см3.
14 У воді розчинили хлороводень об’ємом 2,8 л (н.у.). Об’єм розчину довели до 500 мл. Обчисліть молярну концентрацію розчину хлоридної кислоти.
15 У воді масою 500 г розчинили калій сульфат масою 40г. Густина одержаного розчину 1,064 г/мл. Визначіть молярну концентрацію одержаного розчину.
Завдання ІІ
Напишіть рівняння реакцій ступінчатої дисоціації речовини А. Для кожного ступеня напишіть вираз константи дисоціації.
В |
Речовина А |
В |
Речовина А |
В |
Речовина А |
1 |
H2SO4 |
6 |
H3BO3 |
11 |
Sn(OH)2 |
2 |
Be(OH)2 |
7 |
Mg(OH)2 |
12 |
H2TeO4 |
3 |
H2SiO3 |
8 |
H3PO4 |
13 |
Bi(OH)3 |
4 |
Al(OH)3 |
9 |
Ca(OH)2 |
14 |
H2SeO3 |
5 |
H2S |
10 |
H2CO3 |
15 |
Cr(OH)3 |
Завдання ІІІ
а) Визначіть рН розчину, якщо відома концентрація йонів Н+ чи ОН ¯.
б) Визначіть концентрацію йонів гідрогену, якщо відомий рН розчину.
а) б)
В |
йони |
конц., моль/л |
|
В |
рН |
1 |
Н+ |
3,2·10-5 |
2 |
3,4 |
|
3 |
ОН- |
2,05·10-2 |
4 |
5,8 |
|
5 |
Н+ |
5,6·10-3 |
6 |
,3 |
|
7 |
ОН- |
4,3·10-7 |
8 |
9,4 |
|
9 |
Н+ |
2,1·10-8 |
10 |
14,5 |
|
11 |
ОН- |
4,8·10-10 |
12 |
0 |
|
13 |
Н+ |
2,8·10-4 |
14 |
0,4 |
|
15 |
ОН- |
7,4·10-1 |
|
||
Завдання ІV
1 Які з даних солей гідролізують? Напишіть молекулярні, повні та скорочені йонно-молекулярні рівняння реакцій гідролізу солей для вказаного варіанту. Вкажіть рН середовища.
В |
Солі |
В |
Солі |
В |
Солі |
1 |
Na2S ZnBr2 CH3COONH4 KNO3 |
6 |
Ba(CN)2 CuSO4 (NH4)2S KBr |
11 |
NaNO2 MgSO4 Ba(NO3)2 (CH3COO)2Cu |
2 |
Na2SO3 Fe2(SO4)3 (NH4)2CO3 CaCl2 |
7 |
Na3BO3 ZnSO4 CH3COONH4 BaCl2 |
12 |
NaI CoCl2 Na2CO3 Al2S3 |
3 |
CH3COOK NH4Cl CuCO3 NaClO4 |
8 |
KCN FeCl3 (NH4)2S BaCl2 |
13 |
K2SO4 Fe(NO3)3 Cr2S3 K2CO3 |
4 |
K2CO3 CuCl2 (NH4)2SO3 NaCl |
9 |
K2S Cr(NO3)3 (CH3COO)2Zn NaNO3 |
14 |
Na2SiO3 BeCl2 BaI2 NH4CN |
5 |
BaS AlCl3 (NH4)2CO3 KCl |
10 |
Ba(NO2)2 NH4Br (NH4)2SO3 NaCl |
15 |
Na2S FeSO4 NaClO4 (NH4)2S |
