
- •Фармацевтична хімія
- •Вступ. Загальні положення про аналіз лікарських засобів
- •Методи аналізу лікарських препаратів
- •Загальні реакції на тотожність
- •Визначення функціональних груп
- •Питання для самоконтролю
- •Аналіз чистоти лікарських засобів
- •Кількісне визначення лікарських засобів
- •1. Похідні галогенів
- •1. Препарати гідроген пероксиду
- •Аналіз сполук вісмуту, цинку, купруму, аргентуму, феруму, платини і гадолінію.
- •Загальні реакції, які використовуються в аналізі
- •Сполуки купруму Купруму сульфат
- •Сполуки аргентуму
- •Колоїдні розчини срібла
- •Сполуки феруму Феруму сульфат
- •Органічні фармацевтичні препарати
- •Лікарські речовини – галогенопохідні вуглеводнів аліфатичного ряду
- •Хлороформ (Chloroformium)
- •Фізичні властивості
- •Йодоформ (Iodoformium)
- •Трийодметан
- •Добування
- •Етилхлорид (Aethylii chloridum)
- •Добування
- •Лікарські речовини – похідні спиртів
- •Спирт етиловий (Spiritus aethylicus)
- •У процесі отримання побічними продуктами можуть бути піровиноградна кислота, ацетальдегід, гліцерин, сивушні масла. Для очищення від домішок етиловий спирт переганяють.
- •Гліцерин (Glycerinum)
- •Лікарські речовини – феноли та їх похідні
- •Ф енол чистий (Phenolum purum)
- •Т имол (Thymolum)
- •Ф енолфталеїн (Phenolphtaleinum)
- •Д ля ідентифікації фенолфталеїну використовують реакцію з лугом, при додаванні якого розчин препарату забарвлюється у малиновий колір:
- •Лікарські речовини – похідні альдегідів
- •Розчин формальдегіду 40 %-вий (Solutio Formaldehydi) ф ормалін (Formalinum)
- •Х лоралгідрат (Chloralum hydratum)
- •Лікарські речовини – похідні карбонових кислот аліфатичного ряду
- •Калію ацетат (Kalii acetas)
- •Кальцію лактат (Calcii lactas)
- •Кальцію глюконат (Calcii gluconas)
- •Натрію цитрат (Natrii citras)
- •Лікарські речовини – амінокислоти аліфатичного ряду
- •Кислота глутамінова (Acidum glutamicum)
- •Ц истеїн (Cysteinum)
- •Лікарські речовини, похідні етерів
- •Питання для самоконтролю
- •Лікарські речовини, похідні естерів
- •Лікарські речовини – похідні барбітурової кислоти
- •Лікарські речовини– похідні ароматичних кислот та фенолокислот
- •К ислота бензойна (Acidum benzoicum)
- •С аліцилова кислота (Acidum salicylicum)
- •Н атрію саліцилат (Natrii salicylas) Натрію 2-гідроксибензолкарбоксилат
- •К ислота ацетилсаліцилова (Acidum acetylsalicylicum) Саліциловий естер оцтової кислоти
- •Зберігання
- •Ф енілсаліцилат (Phenylii salicylas) Феніловий естер саліцилової кислоти
- •Органічні фармацевтичні препарати – похідні ароматичних амінів
- •К сикаїн (Xycainum) Лідокаїн (Lidocainum)
- •П арацетамол (Paracetamolum)
- •Лікарські речовини, похідні біс-(β-хлоретил)аміну
- •Сарколізин
- •Лікарські речовини – похідні ароматичних амінокислот
- •А нестезин (Anaesthesinum)
- •Новокаїн (Novocainum)
- •Дикаїн (Dicainum)
- •Лікарські речовини – похідні піразолу
- •Ф еназон (Phenasone)
- •Метамізолу натрієва сіль (Metamizolum natricum) а нальгін (Analginum)
- •Лікарські речовини – похідні гідразиду ізонікотиновоі кислоти
- •Лікарські речовини – похідні 8-оксихіноліну
- •Лікарські речовини з групи алкалоїдів
- •Загальні алкалоїдні реактиви:
- •Спеціальні алкалоїдні реактиви:
- •Похідні тропану
- •А тропіну сульфат (Atropini sulfas)
- •Скополаміну гідробромід (Scopolamini hydrobromidum)
- •Похідні хіноліну : хінін та його солі
- •Хімічні властивості і аналіз якості
- •Похідні бензилізохіноліну : папаверіну гідрохлорид
- •П апаверину гідрохлорид (Papaverini hydrochloridum)
- •Похідні фенантренізохіноліну
- •М орфіну гідрохлорид (Morphini hydrochloridum)
- •Е тилморфіну гідрохлорид
- •Похідні імідазолу: пілокарпіну гідрохлорид, дибазол, метронідазол, клонідину гідрохлорид п ілокарпіну гідрохлорид
- •Похідні пурину
- •Т еобромін (Theobrominum)
- •Лікарські речовини – вітаміни
- •Тотожність
- •Тотожність
- •Лікарськіречовини групи антибіотиків та їх напівсинтетичних аналогів
- •І. Метацикліну гідрохлорид (Methacyclini hydrochloridum). Рондоміцин.
- •Іі. Антибіотики ароматичного ряду Левоміцетин
- •IV. Цефалоспорини
- •V. Антибіотики – глікозиди Стрептоміцину сульфат (Streptomycini sulfas) (дфу)
- •VI. Антибіотики – аміноглікозиди
- •Viі. Лінкоміцини Лінкоміцину гідрохлорид (Lyncomycini hydrochloridum) (дфу)
- •Т ерпінгідрат
- •К амфора
- •Б ромкамфора.
- •Лікарські речовини - комплексоутворюючі сполуки
- •Ф ерамід
- •Етилендіамінтетраацетати
- •Препарат добувають конденсацією етилендіаміну з надлишком монохлороцтової кислоти:
- •О сарсол
- •Металоорганічні сполуки.
- •М еркурійсаліцилова кислота
- •Лікарcькі речовини, продукти переробки нафти
- •Лікарські речовини – гормони та гормоноподібні препарати
- •Гормони мозкового шару наднирників
- •Гормони стероїдної структури
- •1. Реакції, які ґрунтуються на відновних властивостях препаратів:
- •Дезоксикортикостерону ацетат
- •Кортизону ацетат
- •Преднізолон (Prednisolonum)
- •Статеві гормони
- •Андростан
- •Прогестерон (Progesteronum)
- •Література
- •Фармацевтична хімія
- •За загальною редакцією професора і. Ф. Мещишена Українською мовою
Кальцію лактат (Calcii lactas)


СН3–СН–СОО– Са2+∙ 5Н2О
│
ОН 2
Фізичні властивості
Кальцію лактат – білий дрібний порошок без запаху. На повітрі вивітрюється. Повільно розчиняється у воді, легкорозчинний у гарячій воді, малорозчинний у спирті, ефірі та хлороформі.
Добування
Кальцієву сіль молочної кислоти отримують окисленням глюкози в присутності сполук кальцію. Молочна кислота утворюється в результаті бродіння глюкози. Процес протікає під впливом культур молочнокислих бактерій при 35-45˚С. Утворену молочну кислоту нейтралізують, додаючи карбонат кальцію:
С6Н12О6 → 2СН3–СН–СООН
│
ОН
2 СН3–СН–СООН + СаСО3 → СН3–СН–СОО– Са2+ + Н2О + СО2 ↑
│ │
ОН ОН 2
Тотожність
Для випробовування тотожності кальцію лактату з допомогою відповідних аналітичних реакцій виявляють у розчині препарату наявність іонів кальцію та лактат-іонів.
Реакції на іони Са2+:
а) з розчином амонію оксалату утворюється білий осад кальцію оксалату:
Са2+ + С2О4– → СаС2О4↓
б) забарвлення безбарвного полум’я в цегляно-червоний колір.
Реакція на лактат-іони:
Лактат-іон ідентифікують розкладом калію перманганатом в кислому середовищі – утворюється ацетальдегід, який має характерний запах, а розчин перманганату знебарвлюється:
5 СН3–СН–СОО– Са2+ + 4КMnO4 + 11H2SO4 → 10CH3CОН ↑ + 5CaSO4↓ +
│
ОН 2
2K2SO4 + +4MnSO4 + 16H2O + 10CO2↑
Кількісне визначення
К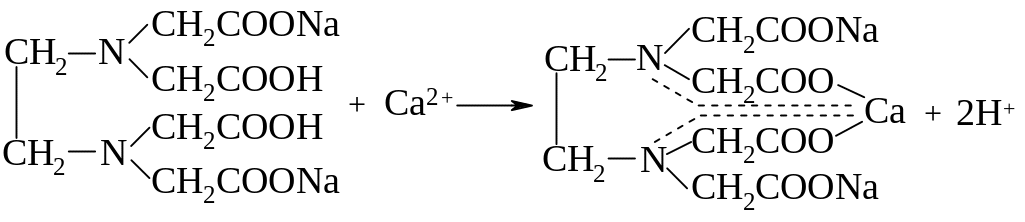 альцію
лактат кількісно визначають
комплексонометричним методом; пряме
титрування 0,05М розчином трилону Б в
присутності аміачного буфера до зміни
забарвлення від червоного до
синьо-фіолетового, індикатор – кислотний
хром темно-синій, Е = М.м.:
альцію
лактат кількісно визначають
комплексонометричним методом; пряме
титрування 0,05М розчином трилону Б в
присутності аміачного буфера до зміни
забарвлення від червоного до
синьо-фіолетового, індикатор – кислотний
хром темно-синій, Е = М.м.:
Зберігання
Кальцію лактат зберігають у добре закупореній тарі, через можливість втрати препаратом кристалізаційної води.
Застосування
Кальцію лактат використовують як джерело іонів кальцію і в якості антиалергенного засобу. По фармакологічній дії він схожий до кальцію хлориду, але здійснює менш подразнюючу дію на слизову оболонку шлунка.
Кальцію глюконат (Calcii gluconas)

Н Н ОН Н
| | | |
НО―СН2―С―С―С―С―СОО Са2+ ∙ Н2О
| | | |
ОН ОН Н ОН 2
Фізичні властивості
Кальцію глюконат – білий зернистий або кристалічний порошок без запаху і смаку. Повільно розчинний у 50 частинах води, розчинний у 5 частинах киплячої води, практично нерозчинний у спирті та ефірі.
Добування
Кальцію глюконат добувають електрохімічним окисленням глюкози в присутності броміду кальцію та карбонату кальцію:
 СOH
СOOH COO‾
СOH
СOOH COO‾
| Br2; H2O | CaCO3 |
( СНОН)4 (СНОН)4 (СНОН)4 Ca2+
| -2HBr | -CO2 |
СН2ОН СН2ОН СН2ОН 2
глюкоза
Тотожність
Реакції на іони Са2+:
а) з розчином амонію оксалату утворюється білий осад кальцію оксалату:
Са2+ + С2О4– → СаС2О4↓
б) забарвлення безбарвного полум’я в цегляно-червоний колір.
2. Реакція на глюконат-іон:
З розчином феруму(ІІІ) хлориду з’являється ясно-зелене забарвлення розчину.
Специфічні домішки декстрину і сахарози відкривають реактивом Фелінга після їх кислотного гідролізу до глюкози – не повинен утворюватися червоний осад.
Кількісне визначення
Кальцію глюконат кількісно визначають комплексонометричним методом; пряме титрування 0,05М розчином трилону Б в присутності амоніачного буфера до зміни забарвлення від червоного до синьо-фіолетового, індикатор – кислотний хром темно-синій, Е = М.м.
Зберігання
Кальцію глюконат зберігають у добре закупореній тарі, через можливість втрати препаратом кристалізаційної води.
Застосування
Кальцію глюконат використовують як джерело іонів кальцію і в якості антиалергенного та кровоспинного засобу. По фармакологічній дії він схожий до кальцію хлориду, але здійснює менш подразнюючу дію на слизову оболонку шлунка.
