
- •Органічна хімія Опорні лекції Нітрогенвмісні органічні сполуки
- •Аміни жирного ряду
- •2. Взаємодія амінів з нітритною кислотою
- •Окислення амінів
- •Ароматичні аміни
- •*Реакції амінів як нуклеофільних реагентів
- •Дія нітритної кислоти
- •Окислення ароматичних амінів
- •Окремі представники амінів
- •* Ароматичні діазо- і азосполуки
- •Амінокислоти
- •Утворення солей з кислотами
- •Реакція декарбоксилювання
- •Ацилювання амінокислот
- •Відношення різних амінокислот до нагрівання
- •Утворення пептидів
Утворення пептидів
Поліпептидна теорія, Е.Фішер (1902) згідно з якою: білки – складні поліпептиди, в яких амінокислоти зв’язані між собою пептидними зв’язками, які утворюються при взаємодії α-карбоксильних ‑СООН- и α-аміно ‑NН2-груп амінокислот:
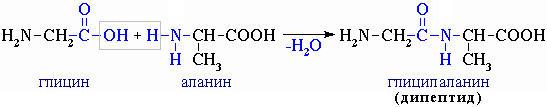
гліцин аланін гліцилаланін (дипептид)
 дипептид
дипептид
Завдання. Назвати дипептид, утворений амінокислотами:
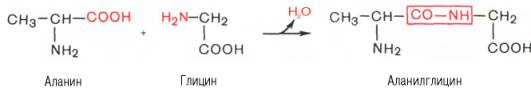
Аналогічно до дипептиду приєднуються інші амінокислоти з утворенням трипептиду, тетрапетиду, пентапептиду, і так до утворення молекули поліпептиду (білка). Утворення пептидного зв’язку між залишками амінокислот є основою побудови молекул кожного білка.
Методи одержання амінокислот
Амінокислоти одержують з природної сировини та методами хімічного синтезу.
Гідроліз білків: кислотний (НСІ, Н2SO4), лужний (КОН, NаOH) і ферментативний (протеолітичними ферментами – пепсином, трипсином)
Під час гідролізу утворюється суміш амінокислот: білок → альбумози → пептони → поліпептиди → олігопептиди → дипептиди → амінокислоти. Амінокислоти виділяють з суміші відповідними методами – кристалізації, хроматографії.
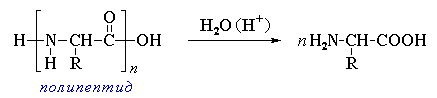
поліпептид амінокислота
Метод мікробіологічного синтезу. Для одержання амінокислот підбирають відповідні поживні середовища, мікроорганізми і проводять інкубацію. Утворену мікробну масу очищають та виділяють з неї окремі амінокислоти. Наприклад, для одержання лізину беруть мелясу і необхідні поживі добавки (кукурудзяний екстракт, фосфати калію, солі амонію, треонін, метіонін, тіамін, біотин), мікроорганізми. Вихід лізину – до 35,7% загальної маси.
Методи органічного синтезу. Синтез із галогенозаміщених карбонових кислот при дії аміаку:
![]()
Біологічна роль амінокислот
Стpуктуpні елементи пептидів і білків. До складу білків входять 20 протеїногенних амінокислот, які кодуються генетичним кодом, і постійно містяться в білкax.
Структурні елeмeнти інших природних сполук. Aмінoкиcлoти та їх похідні входять до складу коферментів, жовчних кислот, антибіотиків.
Наприклад, антибіотик граміцидин на 22% складається із залишків валіну. Серин – попередник ряду амінокислот при їх біосинтезі, складова частина активних центрів багатьох ферментів (трипсину, хімотрипсину, пепсину). Гістидин – складова частина ферментів, його залишки беруть участь у формуванні активних центів молекул багатьох ферментів. Амінокислоти лізин, цистин, цистеїн, аспарагінова кислота входять до складу активних центрів ферментів.
Пepeнoсники сигналів. Деякі aмінoкиcлoти є нейромедіаторами або попередниками гормонів і нейромедіаторів.
Амінокислота тирозин в організмі людини – попередник адреналіну, тироксину і метіоніну, рослин – алкалоїдів морфіну, кодеїну і папаверину. Гістидин – попередник біосинтезу медіатору нервового збудження гістаміну. Використовують як лікувальний препарат. Амінокислота триптофан в організмі людини й тварин, крім структурних і ферментативних функцій (складова частина білків), є джерелом утворення медіаторів триптаміну і серотоніну, гетероауксину, багатьох алкалоїдів в рослинах.
Метаболіти. Амінoкиcлоти — життєво важливі компоненти харчування. Деякі амінокислоти беруть участь в обміні речовин, слугують донорами азоту. Непротеїногенні aмінoкиcлoти утворюються в якості проміжних продуктів при біоcинтeзі та деградації протеїногенних амінокислот або в циклі сечовини.
Наприклад, амінокислота треонін бере участь у нітрогенному обміні. Глутамінова кислота разом з аспарагіновою кислотою бере участь у зв’язуванні і детоксикації аміаку в тканинах і переносі його в печінку у вигляді амідів, де і утворюється сечовина.
Порушення обміну амінокислоти фенілаланіну спричиняє захворювання альбінізмом і фенілпіровиноградною олігофренією.
