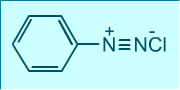- •Органічна хімія Опорні лекції Нітрогенвмісні органічні сполуки
- •Аміни жирного ряду
- •2. Взаємодія амінів з нітритною кислотою
- •Окислення амінів
- •Ароматичні аміни
- •*Реакції амінів як нуклеофільних реагентів
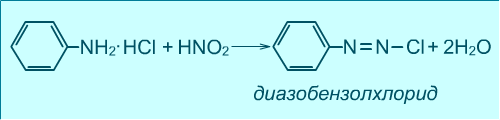
- •Дія нітритної кислоти
- •Окислення ароматичних амінів
- •Окремі представники амінів
- •* Ароматичні діазо- і азосполуки
- •Амінокислоти
- •Утворення солей з кислотами
- •Реакція декарбоксилювання
- •Ацилювання амінокислот
- •Відношення різних амінокислот до нагрівання
- •Утворення пептидів
* Ароматичні діазо- і азосполуки
Діазосполуки – органічні речовини, в молекулах яких є азогрупа, що безпосередньо зв’язана з ароматичним радикалом:
[Ar – N+ ≡ N] CI- ‑ сіль діазонію |
|
|
[Ar – N+ ≡ N] ОН- ‑ гідроксид діазонію |
|
|
|
|
Ar – N = N – ОН – діазогідрат |
|
|
Ar – N = N – ОМе – діазотат |
|
|
|
‑ фенілдіазоній хлорид |
 діазобензен
хлорид
діазобензен
хлорид
Для азосполук характерна реакція азосполучення, яка дає можливість синтезувати багато органічних барвників. Азосполучення відноситься до реакцій електрофільного заміщення. Солі діазонію легко взаємодіють у слабколужному середовищі з фенолами, а у слабко кислому – з ароматичними амінами:
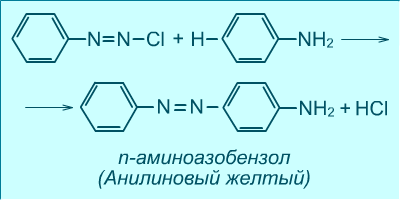
п-аміноазобензен (аніліновий жовтий)
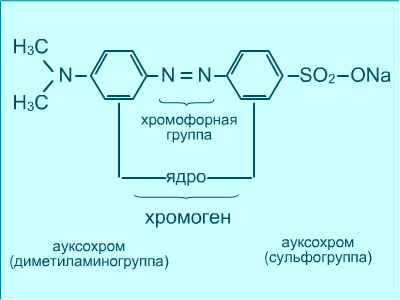
Азосполуки – органічні речовини в молекулі яких міститься азогрупа – N = N ‑, що зв’язана з двома ароматичними радикалами Аr.
С6Н5 ‑ N = N – C6H5 ‑ азобензен
Барвник метиловий оранжевий (метилоранж, геліантин) належить до групи азобарвників (монобарвник): Розчин метилового оранжевого використовують в аналітичній хімії як індикатор. У лужному і нейтральному середовищах метиловий оранжевий має жовте, а в кислому – рожево-червоне забарвлення. |
|
метиловий оранжевий в лужному середовищі (жовте забарвлення) |
Зміна кольору пов’язана зі зміною розподілу електронної густини в молекулі барвника. Так, при переході від лужного до кислого середовища відбувається протонування одного з атомів Нітрогену азогрупи барвника. При цьому із азогрупи – N = N – утворюється нова група – NН ‑ N = і змінюється будова ядра азоскладаючого фрагменту азобарвника – воно стає хіноїдним:





 СН3
СН3
 HOSO3
‑ ─ NH ─ N ═ ═ N+
CI-
HOSO3
‑ ─ NH ─ N ═ ═ N+
CI-
СН3
метиловий оранжевий в кислому середовищі (рожево-червоне забарвлення)
Отже, забарвлення азобарвника залежить від наявності певних угруповань, при зміні реакції середовища змінюється структура молекул барвників та їх забарвлення.
Фарбуючи здатність барвника обумовлена наявністю в його молекулі двох атомних груп: хромофорів та ауксохромів. Хромофори – частини молекули барвників, що мають подвійні зв’язки (‑N=N‑, хіноїдні структури, =С=О, =N=О, нітрогрупа). Ауксохроми в сполученні з хромофорами зумовлюють забарвлення барвника, посилюють або змінюють його відтінки. Ауксохроми мають основні або кислотні властивості, які сприяють взаємодії азобарвника з матеріалом, що фарбується. Приклади: ‑ NH2, ‑N(CH3)2, ‑ OH, _‑SO3H, ‑ COOH. |
|
Амінокислоти
Амінокислоти – похідні карбонових кислот, у радикалі яких один або декілька атомів Гідрогену заміщено на аміногрупу – NH2. |
|
|
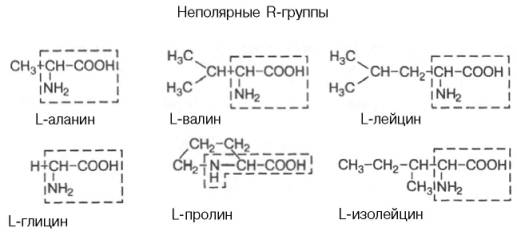
Класифікація амінокислот
|
|
L-аланін L-валін L-лейцин |
|
|
|
L-гліцин L-пролін L-ізолейцин |
|
|
|
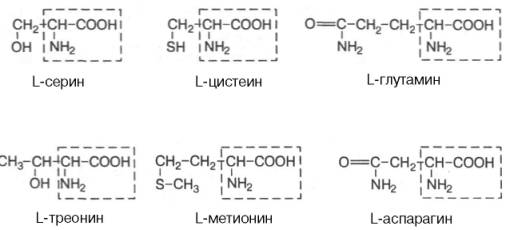
L-серин L-цистеїн L-глутамін |
|
|
|
L-треонін L-метионін L-аспарагін |
|
|
|
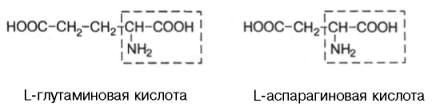
L-глутамінова кислота L-аспарагінова кислота |
|
|
|
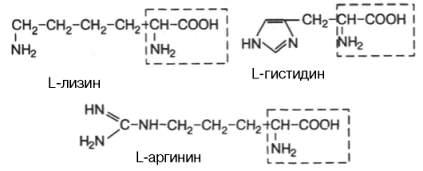
L-лізин L-гістидин |
|
|
|
L-аргінін |
|
|
|
L-фенілаланін L-тирозин |
|
|
|
L-триптофан |
Номенклатура амінокислот
Тривіальна номенклатура (історичні назви): аргінін, лізин, гліцин.
Раціональна номенклатура.
Вказують місце розміщення аміногрупи у вуглеводневому радикалі літерами грецького алфавіту (α, β, λ) + назва карбонової кислоти.
Номенклатура ІЮПАК.
Цифрами вказують місце розміщення аміногрупи і радикала + назва кислоти (за вуглеводнем):
|
|
|
2-амінопропанова кислота (α-амінопропіонова кислота, аланін) |
3-амінопропанова кислота (β-амінопропіонова кислота) |
6-аміногексанова кислота (ε-амінокапроновакислота) |
|
|
|
2-амінобутандіова кислота |
2,3-діамінопропанова кислота |
4-амінобензенова кислота (п-амінобензойна кислота) |
Ізомерія амінокислот
ізомерія карбонового радикала:

2-амінобутанова кислота 2-аміно-2-метилпропанова кислота
ізомерія по місцеположенню в радикалі аміногрупи:

2-амінобутанова кислота 3-амінобутанова кислота
оптична ізомерія (крім гліцину):
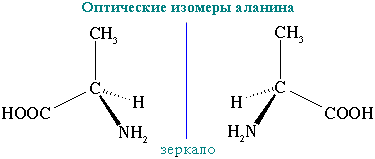
оптичні ізомери аланіну
Фізичні властивості
Амінокислоти – безбарвні кристалічні речовини, добре розчинні у воді, мають високі температури плавлення, можуть розкладатися. Кристалізуються з розчинів у вигляді біполярних іонів. Більшість D-амінокислот солодкі, L-амінокислоти гіркі або без смаку.
Хімічні властивості
Амінокислоти – амфотерні сполуки (взаємодія з мінеральними кислотами і лугами з утворенням солей):

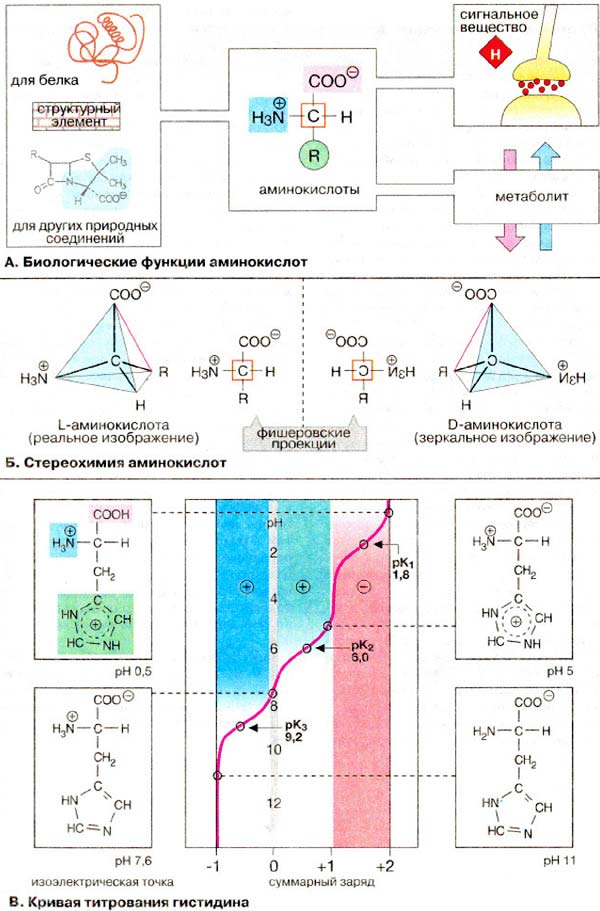
B aмінoкиcлотax містяться дві іоногенні групи тому їх сyмapний зapяд залежить від значення pH середовища.
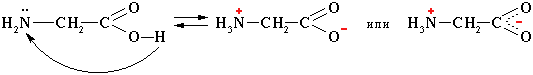
NH2 – CH2 – COOH ↔ +NH3 – CH2 – COO-
гліцин внутрішня сіль гліцину(цвіттер-іон)
*В молекулі гістидину поряд з карбоксильною та аміногрупою наявний імідазольний залишок. Тому при підвищенні рН середовища заряд гістидину змінюється від +2 до -1. При рН = 7,6 сумарний заряд дорівнює нулю, незважаючи на наявність двох повністю іонізованих груп в молекулі гістидину.
Величина рН, при якій сумарний заряд дорівнює нулю, називається ізоелектричною точкою.
В ізоелектричній точці гістидин є цвіттер-іоном, тобто молекула виявляє властивості як аніона так і катіона. B нейтральній області рН більшість амінокислот також є цвіттер-іонами.
Завдання. Визначити реакцію середовища в розчині амінокислоти:
|
|
|
рН ___7 |
рН ___7 |
рН____7 |
У воді амінокислоти дисоціюють: |
|
|
[ОН-]↑, Кр → (кислотні властивості), у вигляді аніонів |
|
[Н+]↑, Кр → (основні властивості), у вигляді катіонів. |