
- •Передмова
- •Робота 1 Загальні правила виконання лабораторних робіт
- •Правила техніки безпеки
- •Правила протипожежної безпеки
- •Перша допомога при нещасних випадках
- •Лабораторне устаткування. Техніка виконання лабораторних робіт
- •П равила зважування на технохімічних вагах
- •Визначення абсолютної та відносної похибки досліду
- •Експериментальна частина
- •Робота 2. Визначення молярної маси еквівалентів металу методом витіснення водню Теоретична частина.
- •Робота 2. Визначення молярної маси еквівалентів металу методом витіснення водню
- •Експериментальна частина. Метод, оснований на вимірюванні об’єму водню, який виділяється при взаємодії металу з кислотою.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 3 Визначення молярної маси карбон (IV) оксиду.
- •Теоретична частина.
- •Експериментальна частина.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 4 Визначення кількісного складу хімічної сполуки. Встановлення її хімічної формули.
- •Теоретична частина.
- •Експериментальна частина.
- •Контрольні питання і задачі
- •Робота 5 Визначення ступеню чистоти карбіду кальцію.
- •Теоретична частина.
- •1 Розчинення твердих речовин
- •2 Фільтрування
- •Експериментальна частина.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 6 Визначення теплового ефекту хімічної реакції.
- •Теоретична частина.
- •Експериментальна частина.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 7 Кінетика хімічних реакцій.
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Вплив природи реагуючих речовин на швидкість реакції.
- •Дослід 2. Вплив поверхні реагуючих речовин на швидкість гетерогенної реакції.
- •Дослід 3. Вплив концентрації реагуючих речовин на швидкість гомогенної хімічної реакції.
- •Дослід 4. Вплив температури на швидкість реакції.
- •Дослід 5. Вплив каталізатора на швидкість реакції.
- •Контрольні питання і задачі
- •Робота 8 Хімічна рівновага.
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Вплив концентрації реагентів на хімічну рівновагу
- •Дослід 2. Зворотність зміщення хімічної рівноваги реакції перетворення хромат – йонів у дихромат – йони.
- •Дослід 3. Вплив температури на хімічну рівновагу.
- •Контрольні питання і задачі
- •Робота 9 Приготування розчинів.
- •Теоретична частина.
- •Експериментальна частина.
- •1. Визначення густини розчину ареометром.
- •2 . Приготування розчину із твердої речовини та рідкого розчинника н2о.
- •3. Приготування розчину певної концентрації методом розбавлення.
- •Контрольні питання і задачі
- •Робота 10 Визначення концентрації розчинної речовини методом титрування.
- •Теоретична частина.
- •Експериментальна частина.
- •Контрольні питання і задачі
- •Робота 11 Визначення вмісту натрій хлориду в суміші
- •Експериментальна частина.
- •Контрольні запитання і задачі
- •Робота 12 Електролітична дисоціація. Властивості електролітів.
- •Теоретична частина.
- •Константа дисоціації матиме такий вигляд:
- •Експериментальна частина. Дослід 1. Визначення електропровідності розчинів.
- •Дослід 2. Вплив концентрації розчину слабкого електроліту на його ступінь дисоціації.
- •Дослід 3. Зміна електропровідності при нейтралізації слабкої основи слабкою кислотою.
- •Дослід 4. Порівняння ступеня дисоціації кислот.
- •Контрольні питання і задачі
- •Робота 13 Реакції у розчинах електролітів. Гідроліз солей.
- •Теоретична частина.
- •Йонний добуток води.
- •Індикатори
- •Гідроліз солей
- •Експериментальна частина Дослід 1. Йонні реакції, які протікають практично необоротно і до кінця.
- •Дослід 2. Забарвлення деяких індикаторів в різних середовищах
- •Дослід 3 Вплив однойменних йонів на дисоціацію слабкого електроліту.
- •Дослід 4. Гідроліз солей.
- •Контрольні питання і задачі
- •Приклади розв’язування задач:
- •Робота 14. Малорозчинні електроліти. Добуток розчинності
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Умови утворення осаду.
- •Дослід 2. Умови розчинення осадів.
- •Дослід 3. Розчинення осадів малорозчинних електролітів при хімічній взаємодії.
- •Контрольні питання і задачі
- •Робота 15 Окисно-відновні реакції
- •Теоретична частина.
- •Метод електронного балансу.
- •Йонно-електронний метод
- •Дослід 5.
- •Дослід 6.
- •Контрольні питання і задачі.
- •Робота 16 Загальні уявлення про електрохімічні процеси. Гальванічні елементи
- •Теоретична частина.
- •Експериментальна частина Дослід 1. Порівняння хімічної активності металів.
- •Дослід 2. Гальванічні елементи.
- •Дослід 3. Складання концентраційного гальванічного елемента.
- •Контрольні питання і задачі
- •Робота 17 Електроліз
- •Теоретична частина.
- •Приклади задач по електролізу водних розчинів солей.
- •Акумулятори
- •Контрольні питання і задачі
- •Робота 18 Корозія металів, захист від корозії
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Утворення гальванічних пар при хімічних процесах.
- •Дослід 2. Корозія внаслідок різного доступу кисню.
- •Дослід 3. Вплив йона Cl- на швидкість корозії.
- •Дослід 4. Анодне і катодне покриття.
- •Контрольні питання і задачі
- •Додатки
- •1. Стандартизовані назви хімічних елементів і простих речовин
- •2. Назви деяких кислот
- •3. Розчинність кислот, основ і солей у воді
- •4. Тиск насиченої водяної пари (рн2о) при різних температурах
- •5. Відносні густини та масова частка (w) розчиненого NaCl при 20°c
- •6. Відносні густини розчинів сульфатної кислоти
- •7. Відносні густини розчинів хлоридної кислоти
- •8. Добуток розчинності малорозчинних речовин у воді при 25 0с
- •9. Стандартні електродні потенціали (e0) металів (ряд напруг)
- •10. Періодична система елементів д.І.Менделєєва
Розрахунки
Приведіть об'єм газу (СО2) до нормальних умов.
![]()
![]()
Обчисліть масу повітря в об’ємі Vо(СО2), враховуючи, що 1л повітря важить 1,293г
1000 мл – 1,293г
V0(CO2) – mпов, г
![]()
3. Розрахуйте масу пустої колби з корком (mn.к)
mn.к = m1-mnов
4. Визначте масу СО2
m(СO2) = m3 - mn.к
5. Розрахуйте густину СО2 за повітрям (або за воднем).
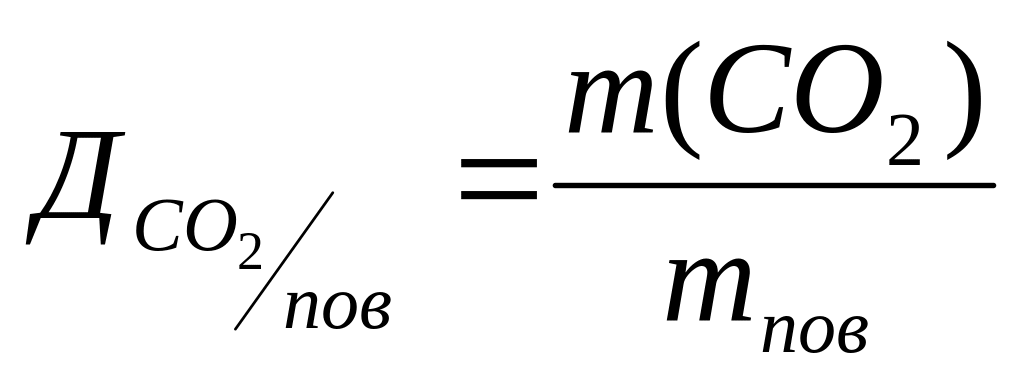
6. Визначте молярну масу карбон (IV) оксиду:
а) за допомогою відносної густини газу
![]()
б) використовуючи мольний об’єм:
V0 (CO2) – m (CO2)
22,4 – M (CO2)
в) за допомогою рівняння Менделєєва-Клапейрона.
![]()
![]()
7. Розрахуйте відносну похибку досліду, %
![]()
Контрольні питання і задачі
Що називається молекулярною масою речовини, мольною або молярною масою молекул? У яких одиницях вимірюється кожна з величин?
Що називається абсолютною і відносною густиною газу?
Чи можна переставляти склянки, що містять розчини натрій гідрогенкарбонату і концентрованої сульфатної кислоти, при очищенні СО2?
Які є методи обчислення молярних мас газів?
Один літр газоподібної речовини за нормальних умов важить 0,76г. Маса одного літра повітря і водню за тих же умов відповідно дорівнює 1,293г і 0,09г. Обчисліть молярну масу газу трьома різними методами.
Маса колби з повітрям дорівнює 64,182 г. Об’єм колби 470 мл, температура 15оС, тиск 102,66 кПа. Розрахуйте відносну густину газу за повітрям і його молярну масу.
Відповідь: 1,53; 44,2 г/моль.
Газ при 96,26 кПа, 21оС має об’єм 1л і масу 2,52 г. Розрахуйте відносну густину газу за воднем і його молярну масу.
Відповідь: 32; 64 г/моль.
Розрахуйте масу 10л азоту за нормальних умов.
Відповідь: 12,5г.
Робота 4 Визначення кількісного складу хімічної сполуки. Встановлення її хімічної формули.
Мета роботи – ознайомлення із методом визначення кількісного складу і виведення хімічної формули різних кристалогідратів.
Теоретична частина.
Хімічний склад сполуки відображає його хімічна формула. Формули речовин показують, які елементи і в якій кількості входять до складу речовини. Розрізняють формули найпростіші і молекулярні.
Найпростіша формула виражає найбільш простий, можливий атомний склад молекул речовини, що відповідає відношенням кількості речовини елементів, які утворюють дану речовину. Молекулярна формула показує дійсне число атомів кожного елемента в молекулі.
Для встановлення найпростішої формули речовини треба знати її атомний склад і атомні маси складових елементів даної речовини.
Для визначення молекулярної формули речовини необхідно, крім складу речовини, знати її молекулярну масу. У випадках, коли хімічні сполуки утворені молекулами складних речовин (наприклад, кристалогідрати), їх склад виражають формулами, в яких указано, скільки молей однієї речовини приходиться на один моль другої. Так, формула FeSO4 • 7H2O показує, що в залізному купоросі на одну молекулу ферум (ІІ) сульфату приходиться сім молекул води.
Приклад: Прокалили 0,500 кристалічної соди. Після прокалювання маса безводної соди виявилась рівною 0,185г. Вивести формулу кристалогідрату.
Рішення: Маса кристалізаційної води m(H2O) дорівнює (0,500 – 0,185), тобто 0,315г.
![]()
Загальна формула кристалогідрату Na2CO3 · xH2O.
Отже:
![]()
Підставляючи у рівняння значення величин, одержимо
![]()
Звідки х = 10
Формула кристалогідрату Na2CO3•10Н2О
