
- •Передмова
- •Робота 1 Загальні правила виконання лабораторних робіт
- •Правила техніки безпеки
- •Правила протипожежної безпеки
- •Перша допомога при нещасних випадках
- •Лабораторне устаткування. Техніка виконання лабораторних робіт
- •П равила зважування на технохімічних вагах
- •Визначення абсолютної та відносної похибки досліду
- •Експериментальна частина
- •Робота 2. Визначення молярної маси еквівалентів металу методом витіснення водню Теоретична частина.
- •Робота 2. Визначення молярної маси еквівалентів металу методом витіснення водню
- •Експериментальна частина. Метод, оснований на вимірюванні об’єму водню, який виділяється при взаємодії металу з кислотою.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 3 Визначення молярної маси карбон (IV) оксиду.
- •Теоретична частина.
- •Експериментальна частина.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 4 Визначення кількісного складу хімічної сполуки. Встановлення її хімічної формули.
- •Теоретична частина.
- •Експериментальна частина.
- •Контрольні питання і задачі
- •Робота 5 Визначення ступеню чистоти карбіду кальцію.
- •Теоретична частина.
- •1 Розчинення твердих речовин
- •2 Фільтрування
- •Експериментальна частина.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 6 Визначення теплового ефекту хімічної реакції.
- •Теоретична частина.
- •Експериментальна частина.
- •Розрахунки
- •Контрольні питання і задачі
- •Робота 7 Кінетика хімічних реакцій.
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Вплив природи реагуючих речовин на швидкість реакції.
- •Дослід 2. Вплив поверхні реагуючих речовин на швидкість гетерогенної реакції.
- •Дослід 3. Вплив концентрації реагуючих речовин на швидкість гомогенної хімічної реакції.
- •Дослід 4. Вплив температури на швидкість реакції.
- •Дослід 5. Вплив каталізатора на швидкість реакції.
- •Контрольні питання і задачі
- •Робота 8 Хімічна рівновага.
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Вплив концентрації реагентів на хімічну рівновагу
- •Дослід 2. Зворотність зміщення хімічної рівноваги реакції перетворення хромат – йонів у дихромат – йони.
- •Дослід 3. Вплив температури на хімічну рівновагу.
- •Контрольні питання і задачі
- •Робота 9 Приготування розчинів.
- •Теоретична частина.
- •Експериментальна частина.
- •1. Визначення густини розчину ареометром.
- •2 . Приготування розчину із твердої речовини та рідкого розчинника н2о.
- •3. Приготування розчину певної концентрації методом розбавлення.
- •Контрольні питання і задачі
- •Робота 10 Визначення концентрації розчинної речовини методом титрування.
- •Теоретична частина.
- •Експериментальна частина.
- •Контрольні питання і задачі
- •Робота 11 Визначення вмісту натрій хлориду в суміші
- •Експериментальна частина.
- •Контрольні запитання і задачі
- •Робота 12 Електролітична дисоціація. Властивості електролітів.
- •Теоретична частина.
- •Константа дисоціації матиме такий вигляд:
- •Експериментальна частина. Дослід 1. Визначення електропровідності розчинів.
- •Дослід 2. Вплив концентрації розчину слабкого електроліту на його ступінь дисоціації.
- •Дослід 3. Зміна електропровідності при нейтралізації слабкої основи слабкою кислотою.
- •Дослід 4. Порівняння ступеня дисоціації кислот.
- •Контрольні питання і задачі
- •Робота 13 Реакції у розчинах електролітів. Гідроліз солей.
- •Теоретична частина.
- •Йонний добуток води.
- •Індикатори
- •Гідроліз солей
- •Експериментальна частина Дослід 1. Йонні реакції, які протікають практично необоротно і до кінця.
- •Дослід 2. Забарвлення деяких індикаторів в різних середовищах
- •Дослід 3 Вплив однойменних йонів на дисоціацію слабкого електроліту.
- •Дослід 4. Гідроліз солей.
- •Контрольні питання і задачі
- •Приклади розв’язування задач:
- •Робота 14. Малорозчинні електроліти. Добуток розчинності
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Умови утворення осаду.
- •Дослід 2. Умови розчинення осадів.
- •Дослід 3. Розчинення осадів малорозчинних електролітів при хімічній взаємодії.
- •Контрольні питання і задачі
- •Робота 15 Окисно-відновні реакції
- •Теоретична частина.
- •Метод електронного балансу.
- •Йонно-електронний метод
- •Дослід 5.
- •Дослід 6.
- •Контрольні питання і задачі.
- •Робота 16 Загальні уявлення про електрохімічні процеси. Гальванічні елементи
- •Теоретична частина.
- •Експериментальна частина Дослід 1. Порівняння хімічної активності металів.
- •Дослід 2. Гальванічні елементи.
- •Дослід 3. Складання концентраційного гальванічного елемента.
- •Контрольні питання і задачі
- •Робота 17 Електроліз
- •Теоретична частина.
- •Приклади задач по електролізу водних розчинів солей.
- •Акумулятори
- •Контрольні питання і задачі
- •Робота 18 Корозія металів, захист від корозії
- •Теоретична частина.
- •Експериментальна частина. Дослід 1. Утворення гальванічних пар при хімічних процесах.
- •Дослід 2. Корозія внаслідок різного доступу кисню.
- •Дослід 3. Вплив йона Cl- на швидкість корозії.
- •Дослід 4. Анодне і катодне покриття.
- •Контрольні питання і задачі
- •Додатки
- •1. Стандартизовані назви хімічних елементів і простих речовин
- •2. Назви деяких кислот
- •3. Розчинність кислот, основ і солей у воді
- •4. Тиск насиченої водяної пари (рн2о) при різних температурах
- •5. Відносні густини та масова частка (w) розчиненого NaCl при 20°c
- •6. Відносні густини розчинів сульфатної кислоти
- •7. Відносні густини розчинів хлоридної кислоти
- •8. Добуток розчинності малорозчинних речовин у воді при 25 0с
- •9. Стандартні електродні потенціали (e0) металів (ряд напруг)
- •10. Періодична система елементів д.І.Менделєєва
Дослід 5.
В дві пробірки внесіть 2-3 кристалика Na2SO3. Одну пробірку залиште, як контрольну. Другу закріпіть у штативі і нагрійте протягом 5-6 хв., потім її охолодіть. В обидві пробірки прилийте по 5-6 крапель дистильованої води, розмішайте скляною паличкою до розчинення солей. В кожну пробірку додайте по 2-3 краплі розчину СuSO4. Запишіть спостереження.
а) Складіть рівняння реакції розкладу Na2SO3. До якого типу окисно-відновних реакцій відноситься ця реакція?
б) Визначте ΔGº298 і встановіть термодинамічну можливість термічного розкладу Na2SO3 з утворенням Na2S(к) і Na2SO4(к).
ΔGº298 (Na2SO3) = - 1002 кДж/моль
ΔGº298 (Na2SO4) = - 1266,8 кДж/моль
ΔGº298 (Na2S) = - 354,8 кДж/моль.
Дослід 6.
а) Встановіть в якому напрямі за стандартних умов буде проходити реакція в розчині.
Fe2+ + Sn4+ → Fe3+ + Sn2+
Стандартні потенціали систем.
Fe3+ + ē = Fe2+ Eº = +0,771 B
Sn4+ + 2ē = Sn2+ Eº = + 0,151 В
б) Визначте константу рівноваги за стандартними електродними потенціалами систем і визначте ступінь проходження реакції в цьому напрямку.
в) До 3 крапель розчину ферум (ІІІ) хлориду прилийте 1-2 краплі розчину амоній роданіду. Визначте зміну забарвлення розчину. Напишіть рівняння реакції. Після чого долийте по краплям до повного знебарвлення розчин станум (ІІ) хлориду. Чи підтвердились розрахунки і висновок? Напишіть рівняння реакції.
Контрольні питання і задачі.
Які реакції називаються окисно-відновними?
Які речовини називають окисниками, відновниками?
Визначте ступінь окиснення cульфуру в сполуках: SO2; H2S; Na2SO3; H2SO4.
Укажіть, які із приведених процесів представляють собою окиснення і які – відновлення:
S → SO42 - ; S → S2 - ; Sn → Sn4+ ; K → K+ ; Br2 → 2Br - ; MnO4¯ → MnO42 -
Закінчіть рівняння реакцій і розставте коефіцієнти за допомогою електронного балансу:
а) K2Cr2O7 + H2SO4 + KI →
б) KMnO4 + H2SO4 + H2O2 →
в) H2O2 + H2SO4 + KI →
Якими способами можливо визначити напрямок окисно-відновної реакції?
Визначте чи можливо протікання реакції в прямому напрямку при 298 К?
СuO(к) + H2(г) = Сu(к) + Н2О(ж)
∆Gº298 (CuO) = - 127,0 кДж/моль
∆Gº298 (H2O) = - 237,2 кДж/моль
Робота 16 Загальні уявлення про електрохімічні процеси. Гальванічні елементи
Мета роботи – засвоєння теоретичного матеріалу про електрохімічні процеси, що протікають при роботі гальванічного елемента.
Теоретична частина.
Електрохімічними називаються процеси взаємного перетворення хімічної і електрохімічної енергії. Із даного визначення випливає, що електрохімічні процеси – це процеси перетворення:
хімічної енергії в електричну, тобто процеси, які протікають в гальванічних елементах.
електричної енергії в хімічну, ці процеси протікають в електролізерах.
При вивченні цієї теми студенти повинні знати наступні поняття.
Шар розчину на межі метал/розчин разом із протилежно зарядженою поверхнею металу утворює подвійний електричний шар. У його утворенні можуть брати участь як зарядженні частини (йони, електрони), так і полярні молекули.
Такий тонкий поверхневий шар із розділених у просторі електричних зарядів із протилежними знаками, які утворюються на поверхні роподілу фаз/розчин називають стрибком потенціалу або електродним потенціалом (Е, В).
Стандартним електродним потенціалом (Ео, В) називається потенціал розчинення металу, зануреного в розчин його солі з концентрацією (або активністю) його йонів, яка дорівнює 1 моль/л, виміряний відносно стандартного водневого електрода, потенціал якого при 25оС умовно дорівнює нулю.
Стандартні електродні потенціали металів (Ео, В), розміщені згідно із зростанням їх алгебраїчних величин, являють собою ряд стандартних електродних потенціалів (ряд напруг металів), який є важливою характеристикою металів.(Додатки, 9).
Метали з низьким електродним потенціалом є активними відновниками. Вони легко окиснюються, але важко відновлюються з йонів.
Кожний попередній метал витісняє всі наступні за ним в ряді напруг метали із розчинів їх солей.
Метали, які стоять у ряді напруг до водню, витісняють його із розведених хлоридної і сульфатної кислот.
Величина електродного потенціалу залежить від природи металу в розчині електроліту і температури.
Цю залежність описує рівняння Нернста.
![]()
де, R – універсальна газова стала, R = 8,314 Дж/К·моль;
T – абсолютна температура, К;
n – заряд йону металу;
F – стала Фарадея, F = 96500 Кл/моль;
CМеn+ - концентрація йонів металу в розчині, моль/л.
Якщо взяти Т = 298 К і замість R i F підставити їх числові значення, то дістанемо рівняння Нернста у вигляді:
![]() +
+![]()
Це рівняння використовується для розрахунку потенціалів металічних електродів.
Гальванічний елемент являє собою пристрій, в якому хімічна енергія окисно-відновної реакції перетворюється на електричну.
Гальванічний елемент складається із внутрішнього кола (двох електродів – анода і катода, занурених у розчин або розплав електроліту) і зовнішнього кола (металічні провідники та інші частини зовнішньої схеми).
Електрохімічними називаються окисно-відновні реакції, які протікають на поверхні електродів у гальванічних елементах. Причому процеси окиснення і відновлення просторово розділені. Окиснення завжди протікає на аноді, відновлення – на катоді. У гальванічному елементі анодом є електрод, потенціал якого за алгебраїчною величиною менший, ніж потенціал катода. Анод позначається знаком “-“, катод – знаком “+”.
Робота гальванічного елемента можлива тільки при замиканні металічного і електролітного кола для переміщування йонів.
Електрорушійна сила (ЕРС) процесу для гальванічного елементу визначається як різниця між потенціалами катода Ек і анода Еа.
П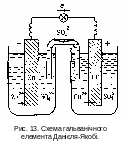 рикладом
гальванічного елемента є мідно-цинковий
елемент Данієля-Якобі, що складається
із цинкової і мідної пластинок, занурених
в розчин сульфатів цинку і купруму.
(рис. 13)
рикладом
гальванічного елемента є мідно-цинковий
елемент Данієля-Якобі, що складається
із цинкової і мідної пластинок, занурених
в розчин сульфатів цинку і купруму.
(рис. 13)
Цинковий електрод є анодом (Ео = - 0,76 В), на якому проходить окиснення цинку:
Zno = Zn2+ + 2ē
Мідний електрод (Ео = + 0,34 В). На цьому електроді проходить відновлення йонів міді із розчину електронами, які утворюються на аноді:
Cu2+ + 2ē = Cuo
Сумарне рівняння процесу в йоному вигляді:
Zno + Cu2+ = Cuo + Zn2+,
або в молекулярній формі:
Zn + CuSO4 = Cu + ZnSO4
Гальванічний елемент виражається схемою:
З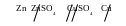 а
стандартних умов ЕРС цього гальванічного
елемента розраховано за формулою
Нернста:
а
стандартних умов ЕРС цього гальванічного
елемента розраховано за формулою
Нернста:
![]()
ЕРС гальванічного елемента під час його роботи поступово зменшується внаслідок поляризації електродів. Поляризація – це зміна потенціалу електрода при проходженні струму. Вона виникає із зміною концентрації розчину електроліту (концентраційна поляризація), а також із зміною хімічного складу поверхні електродів (електрохімічна поляризація).
Для зменшення впливу деполяризації на потенціал електродів використовують різні методи, наприклад, перемішування розчину електролізу або додаванням речовин – деполяризаторами можуть бути О2; MnO2 та ін.
Концентраційними гальванічними елементами називаються такі, в яких елементами називаються такі, в яких електроди виготовлені з одного металу, але вони занурені у розчини електроліту з різною концентрацією. Анодом є електрод з більш негативним потенціалом, де концентрація електроліту нижча.
