
- •§ 1.1. Теорія планка й фотоефект
- •§ 1.2. Лінійчасті спектри атомів і теорія бора про будову атома
- •§ 1.3. Дискретність енергетичних рівнів електронів в атомах і спектри рентгенівських променів
- •§ 1.4. Хвильове рівняння електрона.
- •§ 1.5 Електронна будова атомів
- •§ 2.1. Хімічний зв'язок у молекулах
- •§ 2.2. Агрегатні стани речовини
- •§ 2.3. Кристалічна структура твердого тіла
- •§ 2.4. Хімічні зв'язки в кристалах
- •§ 2.5. Позначення площин і напрямків у кристалі
- •§ 2.6. Теплові коливання атомів
- •§ 2.7. Дефекти кристалів
- •§ 2.8. Визначення структури кристала
- •§ 2.9. Рідкі кристали
- •§ 3.1. Електронні стани в твердих тілах
- •§ 3.2. Метали, діелектрики й напівпровідники з погляду зонної теорії
- •§ 3.3. Статистика носіїв заряду в твердому тілі
- •§ 4.1. Виведення формули електропровідності твердих тіл
- •§ 4.2. Електропровідність металів
- •§ 4.3. Надпровідність металів
- •§ 4.4. Електропровідність власних напівпровідників
- •§ 4.5. Домішкові напівпровідники
- •§ 4.6. Температурна залежність електропровідності напівпровідника
- •§ 4.7. Напівпровідники в області криогенних температур і надпровідність напівпровідників
- •§ 4.8. Вимірювання питомого опору напівпровідників
- •§ 4.9. Визначення типу електропровідності напівпровідників
- •§ 5.1. Вплив сильних електричних полів на електропровідність напівпровідників
- •§ 5.2. Ефект ганна
- •§ 5.3. Нерівноважні носії заряду
- •§ 5.4. Неоднорідні напівпровідники.
- •§ 5.5. Вимірювання параметрів напівпровідників
- •§ 5.6. Гальваномагнітні ефекти
- •§ 5.7. Термомагнітні ефекти
- •§ 5.8. Теплові властивості напівпровідників
- •§ 6.1. Робота виходу та контактна різниця потенціалів
- •§ 6.2. Контакт напівпровідника й металу
- •§ 6.3. Випрямлення на контакті напівпровідника з металом
- •§ 6.4. Контакт металу з електролітом
- •§ 6.5. Будова подвійного шару
- •§ 6.6. Контакт напівпровідника з електролітом
- •§ 6.7. Власний потенціал електрода.
- •§ 6.8. Вольт-амперні характеристики контакту
- •§ 7.1. Утворення р-п-переходів
- •§ 7.2. Класифікація р-п-переходів
- •§ 7.3. Природа струмів через р-п-перехід
- •§ 7.5. Гетеропереходи
- •§ 7.6. Перенос носіїв у тонких плівках
- •§ 7.7. Струми в діелектричних і напівпровідникових плівках, обмежених просторовим зарядом
- •§ 7.8. Надрешітки
- •§ 8.1. Термоелектричні явища
- •§ 8.2. Фотопровідність
- •§ 8.3. Спектр поглинання напівпровідників.
- •§ 8.4. Рекомбінація носіїв заряду
- •§ 8.5. Люмінесценція
- •§ 8.6. Фото-е.Р.С. У напівпровідниках
- •§ 8.7. Квантові генератори
- •8.8. Твердотільні лазери
- •§ 8.9. Поняття про оптоелектроніку
- •§ 9.1. Особливості будови поверхні напівпровідників
- •§ 9.2. Утворення поверхневого заряду
- •§ 9.3. Явище адсорбції на поверхні напівпровідників
- •§ 9.4. Поверхнева електропровідність
- •§ 9.5. Ефект поля
- •§ 9.6. Фізичні явища при переносі носіїв
- •§ 9.7. Канали провідності
- •§ 9.8. Поверхнева рекомбінація
- •§ 9.9. Швидкі й повільні стани
- •§ 10.1. Вплив властивостей поверхні на параметри напівпровідникових приладів
- •§ 10.2. Струм поверхневого витоку
- •§ 10.3. Стабільність характеристик приладів
- •§ 10.4. Стабілізація поверхневого заряду
- •§ 11.1. Особливості структури плівок
- •§ 11.2. Металеві плівки
- •§ 11.3. Епітаксійні шари
- •§ 11.4. Діелектричні плівки
- •§ 11.5. Феромагнітні плівки
§ 1.3. Дискретність енергетичних рівнів електронів в атомах і спектри рентгенівських променів
Повна енергія електрона в атомі складається з кінетичної енергії руху електрона по орбіті Ек і потенціальної енергії Еи притягання електрона до ядра.
Кінетична енергія визначається швидкістю руху електрона по п-ій орбіті:
![]() .
.
Потенціальна енергія залежить від сили притягання електрона до ядра; для атома водню
![]() (1.6)
(1.6)
В атомі водню електрон обертається по орбіті з радіусом rn якщо доцентрова сила, що втримує його на орбіті, врівноважується силою притягання електрона до ядра:
![]() .
.
Користуючись цією рівністю, можна перетворити вираз для Ек:
![]() ,
(1.7)
,
(1.7)
![]() .
(1.8)
.
(1.8)
За допомогою першого постулату Бора (1.5) і виразу (1.7) знайдемо значення радіуса п-й орбіти:
![]() (1.9)
(1.9)
Тоді вираз для повної енергії електрона можна представити у вигляді:
![]()
або, використовуючи формулу (1.9),
![]() (1.10)
(1.10)
З формули (1.10) видно, що енергія електрона в атомі негативна й визначається числом п, що називають головним квантовим числом. Головне квантове число визначає той енергетичний рівень, на якому перебуває електрон. Значенню п = 1 відповідає перший, найближчий до ядра, енергетичний рівень. Електрон на цьому рівні має мінімальну енергію.
Підставивши значення постійних параметрів у формулу (1.10), одержимо для атома водню
Е = 13,6/п2 [еВ].
З викладеного можна зробити висновок, що електрон в атомі здатний приймати тільки строго певні, дискретні значення енергії. Зазначені значення представляються у вигляді енергетичної шкали, кожна риска на якій відповідає певному дозволеному значенню енергії. Всі інші значення енергії є забороненими, тобто електрон не може їх приймати (рисунок 1.9).
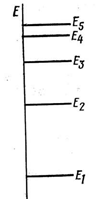
Рисунок 1.9 - Енергетична шкала електронів в атомі
Перехід електрона з одного енергетичного рівня на іншій можливий тільки при дотриманні двох умов:
1) рівень, на який здійснюється перехід, повинен містити «вільне місце» для електрона;
2) для переходу на більше високий енергетичний рівень електрону повинна бути повідомлена додаткова енергія відповідно до третього постулату Бора.
Наприклад, якщо електрон перебуває на рівні Е1, тоді для переходу на рівень Е2 потрібно, щоб там був вільний стан і щоб електрон одержав додаткову енергію ΔЕ = Е2 – Е1.
Стан атома буде стійким, якщо електронами заповнені самі нижні енергетичні рівні. Такому стану відповідає мінімальне значення енергії атома. Якщо під дією опромінення або нагрівання електрон в атомі перейде на більш високий енергетичний рівень, то такий стан атома називають збудженим. Це стан не стійкий, тому при припиненні опромінення електрон повертається у початковий стан, випускаючи квант енергії.
Практичним доказом дискретності енергетичних рівнів електронів в атомах служать спектри рентгенівських променів. Спектри ці бувають двох видів: суцільні, або безперервні, і лінійчасті, або характеристичні. Спектри можна спостерігати за допомогою рентгенівської трубки; схема її найпростішої конструкції представлена на рисунку 1.10. Між анодом (антикатодом) і катодом трубки підтримується різниця потенціалів порядку декількох десятків кіловольт. В якості анода вибирають матеріал, рентгенівський спектр якого досліджується. У звичайних рентгенівських трубках використають матеріали з більшим атомним номером. При поступовому збільшенні напруги на трубці спочатку спостерігається суцільний спектр, а при більших, порядку декількох кіловольтів, напругах - лінійчастий.
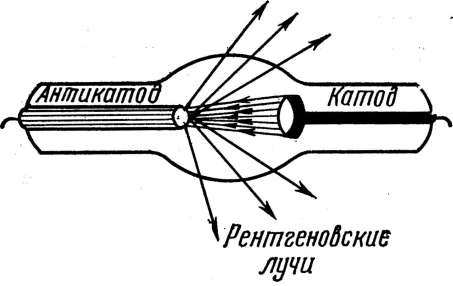
Рисунок 1.10 - Схема найпростішої рентгенівської трубки
Електрон рухається в рентгенівській трубці під дією сил електричного поля від катода до анода. При гальмуванні електрона на аноді виникають електромагнітні коливання, що складаються з набору хвиль різної довжини, що дають суцільний спектр так названого гальмового випромінювання. Електромагнітні коливання, що виникають при гальмуванні електронів, створюють безперервний потік рентгенівських променів. Інтенсивність суцільного спектра збільшується з ростом напруги на трубці й зі збільшенням атомного номера речовини анода. При подальшому збільшенні напруги настає момент, коли крім суцільного спектра виникає й лінійчастий, чіткі лінії якого різко виділяються на тлі безперервного спектра.
З ростом напруги на трубці, спочатку з'являються лінії м'яких серій слабкої інтенсивності. Якщо продовжувати збільшувати напругу, то з'являються промені більше твердих серій. Причина цього полягає в наступному.
Під дією прискореного електрона електрон, що перебуває на внутрішній орбіті атома анода, викидається зі свого рівня на один з більш високих рівнів. Атом збуджується. У той же момент будь-який електрон з більше вилученої від ядра орбіти, що володіє більшою енергією, переходить на місце, що звільнилося, на низькому рівні енергії. При такому переході атом випромінює квант енергії. У результаті збуджений атом повністю втрачає отриману ним енергію й повертається в нормальний незбуджений стан (рисунок 1.11). На суцільному спектрі з'являється лінія, що відповідає випущеному кванту енергії.
Атоми різних елементів поглинають і випускають різні кванти енергії, але завжди строго певні для даного елемента. Чим більше атомний номер елемента, тим більшу порцію енергії він може захопити й випустити.
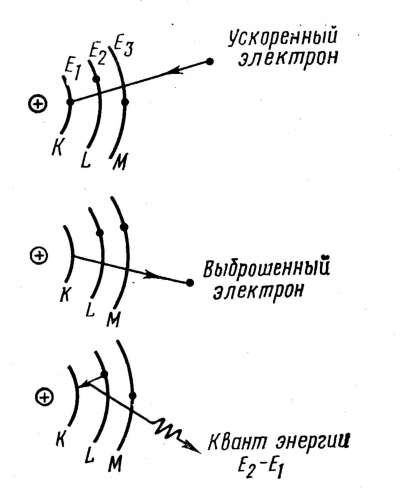
Рисунок 1.11 - Схема виникнення ліній характеристичного спектра
Кожен випущений квант енергії дає на спектрі лінію характеристичного спектра. Ці лінії утворять серію. Серії позначають буквами К, L, М, N. Лінії серії К виникають при переході електронів з різних орбіт на саму внутрішню орбіту, позначувану К; лінії серії L виникають при переході електронів на другу орбіту, позначувану L, і т.д. Лінії в кожній серії позначають буквами α,β,γ; лінії відрізняються друг від друга частотою випромінювання. Лінію, що відповідає переходу електрона з вільного стану на енергетичний рівень атома, називають граничною лінією серії (рисунок 1.12). Лінії К-серії – самі інтенсивні, але число ліній у цій серії найменше.
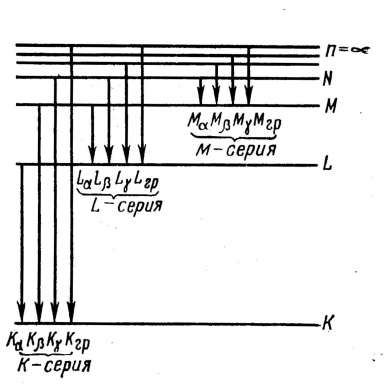
Рисунок 1.12 - Схема можливих переходів електронів в атомах і відповідним цих переходам спектральні серії ліній
Для різних металів необхідна різна напруга для одержання лінійчастого спектра. Так, для молібденового анода при напрузі 0,06 кВ виникають лінії N-серії, при 0,51 кВ – лінії М-серії, при 2,87 кВ – лінії L-серії, при 20 кВ - K-серії. Для вольфрамового анода K-серія виникає при 69,3 кВ, L-серія – при 12,1 кВ.
