7. Інфекційно-токсичний шок при пневмоніях
Захворюваність на пневмонію становить 10-13,8 на 1000. Серед осіб, старших 50 років захворюваність 17 чоловік на 1000. 4 місце серед причин смерті.
Летальність при позалікарняної пневмонії виявляється найменшою (1-3%) у осіб молодого і середнього віку без супутніх захворювань (ХОЗЛ, злоякісні новоутворення, алкоголізм, СД, захворювання нирок і печінки, серцево-судинні захворювання та ін.), А також у випадках важкого перебігу пневмонії (мультілобарная інфільтрація, вторинна бактеріємія, тахіпное 30/мін, гіпотензія, гостра ниркова недостатність) цей показник досягає 15-30%.
До летального результату приводить як правило гостра серцево-судинна недостатність - інфекційно-токсичний шок, летальність при якому становить 30-50%.
ІТШ, розвивається при важких пневмоніях, зазвичай при значній інфільтрації легеневої тканини. Він є відображенням крайнього ступеня інтоксикації, характерною для будь-якої пневмонії. Можна виділити дві групи симптомів, які дозволяють запідозрити можливість розвитку ІТШ у хворого з пневмонією:
Симптоми інтоксикаційного синдрому - гіпертермія більше 39 0 С, тахікардія більше 100 за хвилину, тахіпное більше 30 за хвилину, зміни свідомості (пригнічення, рідше делірій);
«Місцеві» симптоми, що свідчать про об'ємної і протяжної інфільтрації легеневої тканини - поразка більше 1 частки або двостороння пневмонія. Крім того, несприятливими ознаками, що свідчать про просторості інфільтрації можуть бути наступні фізикальні дані:
Різке посилення голосового тремтіння;
Абсолютна тупість при перкусії при відсутності рідини;
Бронхіальне дихання;
Звучні хрипи, крепітація.
|
|
Екзотоксини Екзотоксини - білки, що представляють біофункціональної структуру, тому що вони мають транспортну групу, яка взаємодіє зі специфічним рецептором клітини і токсичне групу (активатор), яка проникає всередину клітини і блокує життєво важливі процеси. Екзотоксини ділять на 3 класи:
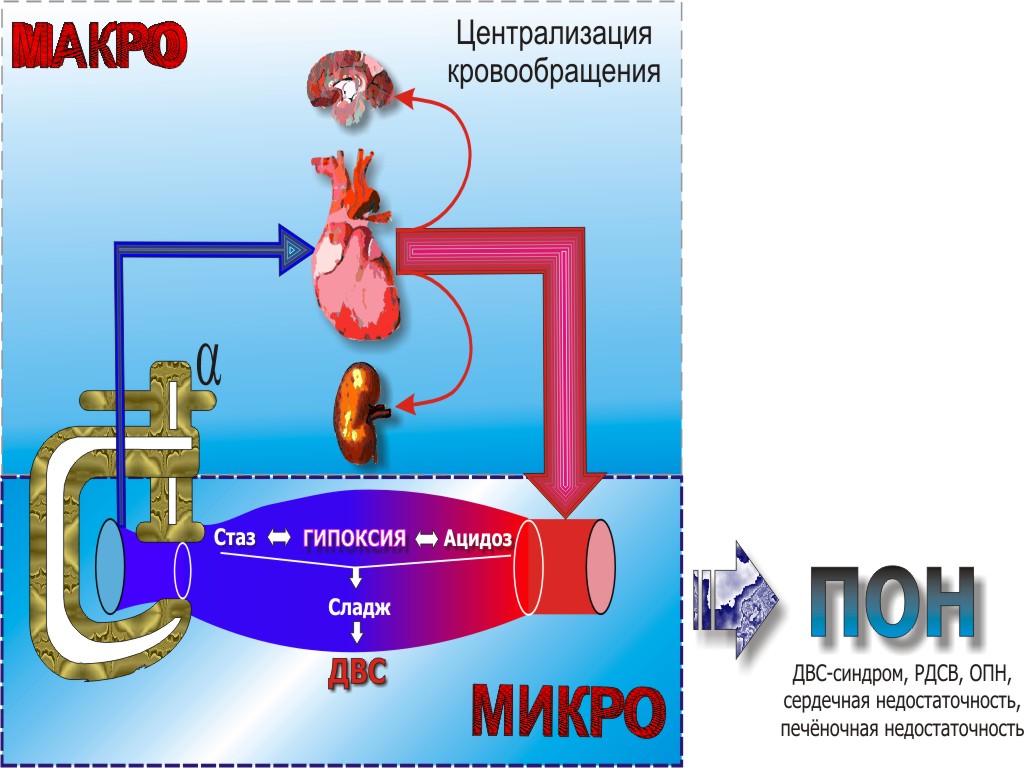
Механізм дії білкових токсинів зводиться до підвищення проникності мембран еритроцитів, лейкоцитів та інших клітин (мембранотоксіни) або до блокади синтезу білка та інших біохімічних процесів в клітинах (цито-, ентеро-і нейротоксини), або порушення взаємозв'язку та взаємодії клітин. Ендотоксини Ендотоксини - білково-ліпополісахарідной комплекси клітинної стінки грацілікут, які виділяються в навколишнє середовище при лізису бактерій. Ендотоксини термостабільні, менш отруйні, ніж екзотоксини, діють швидко, але не володіють специфічністю дії, малочутливі до хімічних речовин, не переходять у анатоксин. Антитіла, які утворюються до Про-специфічним ланцюгах ЛПС, не нейтралізують їх токсичну дію. Основний точної програми дії ендотоксинів є макрофаги, які у відповідь на їх дію виділяють ендогенних пірогенів. Крім того, ендотоксини здатні активувати комплемент по альтернативному шляху. Ендотоксіновий шок найбільш демонстративен при менінгококової інфекції. Характерним є поява симптомів шоку або посилення їх після застосування бактерицидних антибіотиків, що пов'язано з інтенсивним бактеріолізу і викидом ендотоксинів. Дана реакція зустрічається і при іншій етіології ІТШ і також при інфекціях, що протікають без явищ шоку. Наприклад, з цією реакцією стикаються венерологи при лікуванні вторинного свіжого сифілісу. Після перших ін'єкцій пеніциліну у хворих відзначається підвищення температури тіла і посилення запалення в області сифилид - розеоли набувають більш насичений рожево-червоний колір, стають добре видно, як би «підфарбовуються». Це пов'язано з інтенсивним лізисом блідої спірохети і посиленням імунних реакцій на продукти розпаду. Даний тип реакцій називається реакцією загострення Герксгеймера-Яриша-Лукашевича або реакцією бактеріолізу. Він підтверджує участь у патогенезі шоку продуктів розпаду бактеріальних клітин (у разі менінгококової інфекції - менінгококового ендотоксин). Таким чином, в деяких випадках при розвитку ІТШ і високий ризик участі грацілікут в якості етіологічного чинника, перевага може бути віддано не бактерицидну, а бактериостатическим антибіотиків. Патогенез Інфекційно-токсичний шок (син. циркуляторний, септичний, грампозитивних, грамнегативних, ендотоксіновий, екзотоксіновий) - розвивається в результаті впливу ендотоксинів і бактеріальних продуктів на клітинні мембрани, компоненти згортання крові і комплемент, що призводить до підвищення згортання, пошкодження клітин і порушення кровотоку, особливо мікроциркуляції. Система комплементу складається не менш ніж з 20 різних самовстановлюються протеїнів і може бути активована яким-небудь одним із щонайменше двох пускових факторів. Під час активації раніше синтезовані біологічно активні протеїни перетворюються на гуморальні медіатори запалення і альтерації тканин. Активація комплементу відбувається східчасто, на зразок каскаду зсідання крові. Освіта повного комплементу призводить до лізису мембрани клітин бактерій, еритроцитів і інших тканин. Вивільнені під час активації комплементу фрагменти пептидів активують інші клітинні і гуморальні ефекторні системи. Відомі два шляхи активації системи комплементу: класичний і альтернативний. Альтернативна активація (звана також пропердіновой) може відбутися під впливом неіммунологіческой чинників, незалежно від антитіл. У літературі є дані про активацію комплементу ліпополісахаридів (ендотоксини). Активація комплементу призводить до утворення низькомолекулярних пептидів - факторів комплементу С3, С4 і С5, опосередковуючи клітинні і гуморальні реакції. Фрагменти С3а, С4а і С5а називають анафілотоксинів. Вони стимулюють вивільнення гістаміну з тучних клітин і базофілів, викликають скорочення гладких м'язів і збільшують проникність судин. Вважається, що фрагмент С2 має кінінової активністю, викликаючи збільшення проникності судин. Частковий С5а, взаємодіючи зі специфічними високоафінними рецепторами гранулоцитів і тромбоцитів, викликає агрегацію клітин, посилення прилипання, хемотаксис і активацію клітин. Активовані таким чином нейтрофіли вивільняють метаболіти арахідонової кислоти, безкисневі радикали і лізосомальні ферменти, що викликають запальні зміни в тканинах і які збільшують проникність капілярів. Цей механізм може мати певне значення у виникненні дихальної недостатності і вазодилатації при септичному стані, викликаному грамнегативними мікроорганізмами. Літературні дані, отримані останнім часом свідчать також про те, що під впливом ендотоксинів та інших бактеріальних продуктів виділяються ендогенні цитокіни, основними мішенями для яких є лейкоцити, ендотелій і серце. З'являються медіатори запалення і самі ендогенні цитокіни мають великий вплив на вазомоторний тонус, проникність дрібних судин і агрегацію лейкоцитів і тромбоцитів. Відбувається перебудова в термінальному відділі системи кровообігу. У результаті цього виникає втрата тонусу як судин опору (артеріальних), так і об'ємних (венозних). Кров може накопичуватися в капілярному руслі, а білки плазми пропотевает в інтерстиціальну рідину. У венозній системі також відзначається депонування крові. У результаті стимуляції b-рецепторів відкриваються артеріовенозні шунти кінцевої частини кровотоку. Досить важливе значення в патогенезі інфекційно-токсичного шоку в даний час надається також утворенню в організмі нітратів. При запальної реакції в організмі ключову роль в утворенні нітратів грають макрофаги. Специфічний фермент макрофагів - NO-синтетаза (макрофагальна, яка локалізується в макрофагах, міокарді і гладких м'язах) перетворює аргінін в NO, з якого потім можуть утворюватися нітрити та нітрати. Головна функція NO, який синтезується макрофагами, полягає у забезпеченні їх цитотоксичної дії. При активації бактеріальними ендотоксинами або Т-лімфоцитами макрофаги посилюють синтез NО-синтази, яка перетворює аргінін в NO. Виділяючись з макрофагів, NO швидко проникає в бактерії і клітина гине. Таким чином, NO відіграє важливу роль в імунному захисті організму. Крім того NO сприяє зниженню активності прикордонних запальних клітин, гальмує агрегацію тромбоцитів і поліпшує місцевий кровообіг. Патогенний ж вплив освіти NO в організмі при запаленні може полягати в наступному. При запальних процесах в організмі можуть утворюватися активні форми кисню, які є однією з важливих молекулярних мішеней для NO. NO зв'язується з киснем, утворюючи піроксінітріти, за токсичністю в багато разів переважаючі NO. Вони то і грають важливу роль у багатьох патофізіологічних процесах, включаючи септичний шок, а також ішемічні та виразкові ураження органів. Піроксінітріт викликає пошкодження білків і ліпідів клітинних мембран, пошкоджує судинний ендотелій, збільшує агрегацію тромбоцитів, бере участь у процесах ендотоксемії. Сама NO, надлишково накопичуючись в клітині, може викликати пошкодження ДНК і володіти прозапальною дією при септичному шоці. Таким чином, на початковому етапі розвитку захворювання під впливом ендотоксинів відбувається в першу чергу розширення стінок дрібних судин (в основному венул), а також значно підвищується проникність судинної стінки. У результаті всього вищевикладеного, незважаючи на відсутність абсолютного дефіциту об'єму, венозне повернення до серця зменшується (відносна гіповолемія). У відповідь на це відбувається рефлекторне симпатическое звуження вен. Але активне звуження вен ефективно зменшує венозний кровонаповнення тільки в тому випадку, якщо вени добре наповнені й розтягнуті. Якщо ж трансмурального тиску досить низько, щоб привести вени в полуспавшееся стан, навіть сильні скорочення гладкої м'язи вен надають тільки незначний вплив на кількість крові в них. При такій ситуації звуження вен може навіть дещо збільшити місцеву ємність вен, так як воно робить стінку більш жорсткою, в результаті чого просвіт стає великим і набуває більш круглу форму, незважаючи на те, що просвіт окружності зменшується. У результаті зниження венозного повернення підвищується активність симпатичної нервової системи, що поряд з безпосереднім впливом ендотоксинів веде до скорочення пре-і посткапілярних сфінктерів (стимуляція a-рецепторів). У результаті кровопостачання тканин стає недостатнім, хвилинний об'єм серця в цю фазу здебільшого нормальний або навіть підвищений (тобто МОС нормальний або збільшений, ЧСС збільшується, загальний периферичний опір зменшується і знижується артеріальний тиск). Артеріо-венозна різниця по кисню та забезпечення периферії киснем знижені. Надалі в міру подальшого розвитку шоку відбувається формування фатального порочного кола. Прекапілярні артеріальні сфінктери більш чутливі до токсичних впливів (в тому числі ацидозу), тому їх спазм швидко змінюється парезом. Посткапілярні (венулярного) сфінктери більш стійкі до метаболічних порушень і тривалий час залишаються в стані тонічного напруження. Таким чином, кров, притікає в капілярне русло депонується, у зв'язку з чим наростає тканинна гіпоксія, посилюється метаболічний ацидоз, пропотіває плазма з наростаючою компресією капілярів, що поряд із застоєм крові у венозному руслі, сприяє подальшому зменшенню венозного повернення і збільшення відносної гіповолемії. У результаті виникає наступна причинно-наслідковий зв'язок: стаз в капілярах - вісцеральний застій - догляд води - підвищення в'язкості крові - агрегація червоних і білих кров'яних тілець, освіта червоного і білого тромбу - виснаження факторів згортання і тромбоцитів внаслідок дисемінованого внутрішньосудинного згортання - виникнення виснажливої коагулопатії з підвищеною схильністю до кровотечі. В уражених областях аеробні енергетичні шляхи перемикаються на анаеробний гліколіз. Переключення окисного обміну на гліколітичні шлях значно збільшує споживання глюкози при одночасному зменшенні виходу АТФ. Це знову веде до зниження рівня глюкози. Біосинтез білка при шоку обмежений. Це особливо швидко впливає на синтез тих білків, які мають короткий час напівжиття, наприклад, фактори згортання. Таким чином, порушення згортання крові ще більше посилюється. При шоку починається вихід калію з клітин. Метаболічний ацидоз виникає в результаті збільшеної продукції лактату, а також пірувату, a-кетоглутарату і кетонових тіл. Ацидоз частково компенсується посиленим диханням. У результаті підвищення концентрації Н + у плазмі спостерігається наступне: негативну інотропну дію на серце; зниження чутливості прекапілярних сфінктерів у сенсі вазомоторних реакцій з утворенням набряків; підвищення викиду катехоламінів; активування системи згортання в якості однієї з причин дисемінованого внутрішньосудинного згортання. Деякі речовини, які утворюються при шоку (зокрема й самі цитокіни), мають негативну інотропну дію. Тривала дія цих факторів веде до розширення серця та серцевої недостатності, тим самим, до зменшення МОК. Нирки. Унаслідок еферентної скорочення судин при шоку зменшується тиск гломерулярної фільтрації, в результаті чого розвивається олігурія (4-20 мл / год) або анурія (4 мл / год). Звуження ниркових судин зберігається ще довгий час після нормалізації тиску крові. Ішемія викликає прогресуючий некроз канальців внаслідок гломерулярної, а потім тубулярної недостатності з утворенням циліндрів в дистальних канальцях. Ознакою ниркової недостатності є збільшення вмісту в крові таких, зазвичай виділяються з сечею сполук, як сечовина і креатинін. Таким чином, одним з основних патофізіологічних механізмів у розвитку інфекційно-токсичного шоку при пневмоніях слід вважати розвиток гіповолемії внаслідок секвестрації крові в мікроциркуляторному руслі і виходу її в тканини через підвищення проникності капілярів. За образним висловом І. Теодореску-Ексарі при ІТШ відбувається «кровотеча у власні судини». Патогенетичні стадії Стадія компенсації Компенсаторні пресорні реакції, спрямовані на підтримання АТ і заповнення ОЦК. Відбувається викид катехоламінів, що викликають спазм прекапілярних сфінктерів. Відкриваються прямі артеріовенозні шунти. Стадія субкомпенсації Ініціальний спазм прекапілярів змінюється парезом і застоєм крові у віно-венулярного відділі мікроциркуляторного русла. У цю стадію розвивається циркуляторна недостатність (шок). Знижується венозне повернення до серця знижується серцевий викид. Включаються компенсаторні реакції - тахікардія, резорбція провізорного фільтрату в ниркових канальцях. При зменшенні венозного повернення на 25-30% починається декомпенсація зі зниженням артеріального тиску і порушенням перфузії життєво важливих органів. У цих умовах реалізуються механізми централізації кровообігу. Наростає метаболічний ацидоз тахіпное. виникають біоплярние зміни КОС - респіраторний алкалоз в малому колі і метаболічний ацидоз у великому. Стадія декомпенсації Характеризується приєднанням ДВС-синдрому тканинна гіпоксія зміни до шокових органах. «Предтечею» ДВС синдрому є зміна реології крові - сладж феномен. У нормальних умовах кров має характер стабільної суспензії. Збереження суспензійної стабільності крові забезпечується величиною негативного заряду еритроцитів і тромбоцитів (дзета-потенціал - потенціал поверхні ковзання частки в колоїдному розчині), що визначається співвідношенням білкових фракцій (альбуміни / глобуліни) і достатністю кровотоку. Зменшення негативного заряду еритроцитів (збільшення глобулінів або фібриногену, їх абсорбція на поверхні еритроцитів) призводить до розвитку сладжірованія крові. Сладж (від англ. Sludge - густий бруд, твань) - зміна реології крові, що характеризується прилипанням один до одного еритроцитів, лейкоцитів і тромбоцитів і підвищенням в'язкості крові, що ускладнює її перфузію через мікросудини. Сладж може бути оборотним (тільки при агрегації еритроцитів) і необоротних (аглютинація еритроцитів). Типи сладжа:
Сладж різке уповільнення кровотоку, сепарація плазми від еритроцитів, маятнікообразние руху плазми стаз. У зв'язку із закупоркою термінальних артеріол великою кількістю агрегатів, капілярні судини пропускають тільки плазму. При цьому пошкоджується стінка судин (набухання, десквамація ендотелію). Паралельно з процесами сладжірованія і передуючи їм відбувається порушення проникності судин обміну (капіляри, венули) у бік її підвищення. Це призводить до виходу рідкої частини крові в інтерстицій і згущення крові, що посилює процеси агрегації еритроцитів. Морфологічною основою проникності судин є ендотелій і базальна мембрана + периваскулярная тканину = неспецифічний гістогематичні бар'єри. У морфологічному відношенні підвищення судинної проникності характеризується збільшенням проміжків між ендотеліоцитами внаслідок скорочення і посилення везикулярного транспорту. Раннє підвищення проникності пов'язані з впливом біологічно активних амінів і брадикініну, пізніше (більше 60 хвилин) - протеаз, каллидин, глобулярних речовин нейтрофілів. Дія цих речовин направлено на стінку капілярних судин - міжклітинний цемент ендотелію і базальну мембрану і полягає у фізико-хімічних змінах (деполімеризація складних білково-полісахаридних комплексів). Схема патогенезу шоку
Клінічна картина Шок розвивається на тлі наростання інтоксикації: у хворого з'являється озноб, за яким слідує різкий підйом температури, часто спостерігається нудота, блювання, діарея, стан прострації. У клінічному плані виділяють наступні групи симптомів, що визначають ступінь тяжкості і прогноз.
До ранніх ознак починається ІТШ відносяться гіпервентиляція, що викликає респіраторний алкалоз, і церебральні порушення у вигляді занепокоєння або загальмованості. Ці перші симптоми шоку часто не привертають увагу, що призводить до запізнілої діагностики й погіршує прогноз. У міру розвитку хвороби посилюється тахікардія, задишка, артеріальна гіпотензія, а іноді тенденція до гіпертензії, спостерігається блідість кінцівок з акроцианозом. Шкірні покриви теплі і сухі («теплий шок»). При дослідженні в цей період визначається: зниження ОПСС і можуть з'являтися ранні ознаки зниження фракції викиду (нормалізується на 7-10 добу), збільшення серцевого викиду, ЧСС, частоти подихів і Ро 2 змішаної венозної крові (через артеріовенозного скиду) При прогресуванні шоку розвивається артеріальна гіпотензія, наростає олігурія. При дослідженні у цих хворих відзначаються низькі значення центрального венозного тиску (ЦВТ), низький обсяг циркулюючої крові (ОЦК) і серцевий викид, відзначається підвищення ОПСС, ЛСС, альвеолярно-артеріального градієнта Ро 2, зменшення рН і Ро 2 в артеріальній крові тобто . гіподинамічного реакція системного кровообігу, наростає олігурія і молочнокисла ацидемії. Виникає поліорганна недостатність (СН, гостра ниркова недостатність, РДСД, печінкова недостатність, ДВЗ-синдром). Основні ознаки інфекційно-токсичного шоку
Прогноз відносно сприятливий, якщо швидко розпочато належна терапія. У II стадії летальність 40%, у III - 60%. У міру розвитку шоку відзначається подальше зниження артеріального тиску, колір шкірних покривів сірий, кінцівки холодні. При дослідженні визначається збільшення показників ЦВТ, виражений метаболічний ацидоз і дуже висока концентрація молочної кислоти. Прогноз дуже несприятливий. Надалі артеріальний тиск падає до 50-20 мм рт. ст. і нижче, а часто не визначається. У деяких хворих відсутній температурна реакція і навіть спостерігається гіпотермія. У хворих низькі показники ЦВТ, низький ОЦК, серцевий викид і виражена молочнокисла ацидемії, яку не компенсує респіраторний алкалоз. Змінюються електроліти крові, відзначається тенденція до гіпонатріємії та гіпокаліємії. На ЕКГ можуть реєструватися зміни, іноді трудноотлічімие від таких при гострому інфаркті міокарда. У таких хворих настає кома. Летальність при таких проявах досягає 100%. Причини смерті: поліорганна недостатність (50%), стійка артеріальна гіпотензія (40%), важка серцева недостатність (10%). стадії ІТШ
Лікування В основі раціонального лікування при ІТШ лежить ретельне спостереження за хворим. Дуже корисна безперервна реєстрація клінічних даних. Біля ліжка хворого особливо важливо стежити за деякими основними показниками: 1. Стан легеневого кровотоку (і бажано функцію лівого шлуночка) контролюють за допомогою катетера Свана-Ганц. При його відсутності необхідно вимірювати центральний венозний тиск (ЦВТ). Введення катетера у великі вени або в праве передсердя дозволяє отримати точні дані про зв'язок між станом правого шлуночка і об'ємом циркулюючої крові, що дає можливість регулювати обсяг введеної рідини. ЦВД вище 12-14 см вод. ст. вказує на деяку небезпеку продовження введення рідин і загрозу розвитку раптового набряку легенів. 2. Пульсовий тиск дозволяє оцінити величину ударного обсягу серця. 3. Звуження шкірних судин свідчить про опір периферичних судин, хоча і не відображає повністю порушення кровотоку в нирках, мозку чи кишечнику. 4. Погодинне вимірювання об'єму виділеної сечі дозволяє контролювати рівень кровотоку у внутрішніх органах і ступінь їх перфузії. Зазвичай для цього необхідно введення постійного сечового катетера. обов'язковим терапевтичним заходом для даної категорії хворих є дотримання постільного режиму! (Враховуючи наявність недостатнього венозного повернення, що може збільшуватися у вертикальному положенні). Велике значення в проведенні лікувальних заходів у хворих з ІТШ має, поряд з активною АНТИБІОТИКОТЕРАПІЯ, інфузійна терапія. При проведенні інфузійної терапії необхідно враховувати, що при пневмоніях, частіше вірусно-бактеріальних на тлі наявних змін в легенях внутрішньовенне введення розчинів, особливо фізіологічного та 5% глюкози, може призвести до набряку легень, а в деяких випадках і до набряку мозку. Тому проводити інфузійну терапію необхідно строго диференційовано з урахуванням конкретних показань і під постійним контролем за загальним станом, рівнем гемодинаміки, діурезом, показниками ЦВД, а також за об'єктивними даними з боку легенів. Зазвичай у хворих з гострою серцево-судинною недостатністю інфузію починають з поліглюкіну, після проведення проби на реактогенність: протягом 1-ї хвилини вводять об'емвосстанавлівающій (замісник) розчин зі швидкістю 10-15 кап / м, потім робиться 3 хвилинну перерву - оцінка самопочуття хворого , 2-а хвилина - 20-30 кап / м, потім 3 хв перерва - оцінка самопочуття хворого. Якщо стан не погіршився, проводиться в / в крапельне введення препарату з необхідною швидкістю, але не більше 60-80 крапель за хвилину. Поліглюкін вводиться якщо рівень артеріального тиску менше 100 мм рт. ст. Якщо тиск становить 100-110 мм рт. ст. можна вводити реополіглюкін, який дає не тільки гемодинамічний та дезінтоксикаційний ефект, але і покращує мікроциркуляцію, усуває стаз в капілярах, знижує адгезію та агрегацію тромбоцитів, що лежить в основі його антитромботичного дії. Зазвичай вводиться 400 мл поліглюкіну і 400-600 мл реополіглюкіну. Якщо ефект недостатній, використовується плазма, альбумін. При відсутності перерахованих вище препаратів в / в протягом 5 хвилин вводять 200 мл 0,9% NaCl або розчин Рінгера з лактатом. За відсутності ефекту додатково вводять 1-1,5 л розчинів за 20 хвилин. Якщо симптоми шоку зберігаються, показаний інвазивний моніторинг гемодинаміки та введення 2-4 літрів інфузійних розчинів за 1 годину. При важкому шоці, а також при набряку легенів показані вазопресорні кошти. Так само можуть бути використані препарати гідроксиетилкрохмалю, які більш ефективно, ніж декстранових похідні попереджають синдром надлишкових капілярних втрат. Інфукол ДЕК (рефортан, стабізол) випускається у вигляді 6% і 10% розчину у флаконах по 100, 250 і 500 мл. Середня / максимальна доза становить 2 г / кг, що відповідає 33 мл 6% розчину або 20 мл 10% розчину. Вводять внутрішньовенно, краплинно. Перші 10-20 мл вводять повільно (контроль загального стану для виключення анафілактоїдних і анафілактоїдних реакцій). Препарат протипоказаний при гіпергідратації, декомпенсованої серцевої недостатності, ниркової недостатності з олігурією та анурією, при вираженому порушенні згортання. Вазопресорні кошти. Дофамін, 5-20 мкг / кг / хв в / в; у відсутності ефекту додають норадреналін, 0,5-30 мкг / хв в / в, по можливості зменшуючи дозу дофаміну до «ниркової» (2-4 мкг / кг / хв). Режими дозування допаміну:
Розрахунок дози. 800 мг препарату (вміст 4 ампул допаміну по 200 мг у кожній) розчиняється в 500 мл 5% розчину глюкози. 1 мл суміші містить 1,6 мг препарату. Для більш точного дозування краще всього використовувати педіатричні мікрокраплинної дозуючі системи (1 мл = 60 мікрокрапель). При цьому 1 мікрокраплях містить 26,7 мкг допаміну. По таблиці виробляють перечет мкг / кг / хв у мікрокраплі / хв. При використанні звичайної системою (1 мл = 20 крапель) швидкість введення (мікрокраплі / хв) слід розділити на 3. Інотропні кошти. При низькому серцевому викиді до інфузії дофаміну або норадреналіну додають добутамін, 5-20 мкг / кг / хв. До побічних реакцій перерахованих вище препаратів відносять ектопічні порушення ритму, нудоту і блювоту і іноді тахікардію. Вони зазвичай нівелюються при зменшенні дози препарату. Ефективність кортикостероїдів для виведення хворих з самого інфекційно - токсичного шоку в даний час не доведена, хоча, можливо, якесь позитивне дію на біологічні мембрани вони можуть надати. Зокрема, в літературі є вказівки на те, що вироблення NO може сповільнюватися або зникати під впливом глюкокортикостероїдів. Проте при всіх видах шоку застосовують ГКС, зазвичай преднізолон в дозі 5-10-20 мг / кг / сут. Експериментальні методи: застосування великих доз налоксону, НПЗП, моноклональних антитіл до ендотоксину і фактору некрозу пухлин, антагоністів рецепторів інтерлейкіну-1 і антагоністів оксиду азоту. Для корекції гемостазу (у тому числі й боротьба з ДВС синдромом) рекомендується гепарин в добовій дозі близько 20000 ОД, який також є інгібітором біологічно активних речовин, що беруть участь у запаленні. Що стосується введення антибіотиків, то препарати слід вводити внутрішньовенно, при цьому бажано використовувати бактерицидні антибіотики. У розпал інфекційно-токсичного шоку антибактеріальна терапія повинна здійснюватися за скороченою програмою - разові і добові дози антибактеріальних препаратів повинні бути зменшені принаймні в 2 рази. При супутніх захворюваннях серцево-судинної системи можливе застосування бактеріостатичних антибіотиків. Корисним може виявитися застосування курантил або изоптина (Фіноптину) як засобів захисту міокарда від гіпоксії. Дуже ефективним може виявитися компламін і трентал. Хворим, у яких не дивлячись на підвищену ЦВД або тиск у судинах легенів, зберігається гіпотензія, можуть допомогти серцеві глікозиди (корглікон, строфантин, дигоксин або ізоланід), за умови відсутності добутаміну. Показано також введення препаратів, що надають позитивний вплив на венозний тонус (водорозчинна камфора - сульфокамфокаїн, кордіамін і т. д.). Дуже важливо підтримувати сечовиділення з тим, щоб попередити некроз ниркових канальців. За відновлення обсягу циркулюючої крові при стабілізації артеріального тиску додаються при необхідності сечогінні препарати (20-60 мг лазиксу, буфенокс або 200 мл 10% манітолу (при наявності серцевої недостатності). У багатьох хворих з ІТШ Ро 2 артеріальної крові помітно знижене. У зв'язку з цим їм з самого початку важливо забезпечити вільне дихання і надходження кисню через носовий катетер, маску або трахеостому. При нормальному або кілька зниженому АТ, але вираженої загальної інтоксикації та гіпертермії інфузійна терапія є переважно дезінтоксикаційної із застосуванням гемодезу (200-400 мл протягом 2 днів). При великому запальному процесі в легенях (ураження частки, 3 сегментів) рекомендується застосування нестероїдних протизапальних препаратів (індометацин, вольтарен по 100-125 мг / добу). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||