- •Санкт-Петербург
- •Содержание
- •Введение
- •Аннотация
- •1. Значение, общие принципы и методы технического анализа Основные понятия: технический контроль производств, технический анализ
- •Технический анализ – важнейшая составная часть технического контроля производств
- •Классификация методов технического анализа
- •Аналитический процесс Пробоотбор и пробоподготовка
- •Измерение и оценка результата Чувствительность аналитической методики
- •Случайная и систематическая погрешности
- •2. Гравиметрический (весовой анализ) Сущность гравиметрического анализа, его возможности и точность. Практическое значение метода
- •Разновидности гравиметрического анализа Форма осаждения и весовая форма
- •Требования, предъявляемые к форме осаждения и весовой форме
- •Контроль полноты осаждения
- •Образование осадков, их свойства, зависимость характера осадков от условий осаждения
- •Гравиметрическая форма.
- •Выбор осадителя; органические осадители.
- •Расчеты в гравиметрическом анализе; соотношение эквивалентности, аналитический фактор
- •Основные методы титриметрического анализа. Основные приемы титрования
- •Метод кислотно-основного титрования (нейтрализации)
- •Индикаторы в методе кислотно-основного титрования
- •Кривые титрования
- •Окислительно-восстановительное титрование (оксидиметрия), его разновидности
- •Титрование по методу осаждения. Комплексометрическое титрование
- •Выражение концентрации рабочих растворов. Расчеты в титриметрии
- •Термометрическое титрование.
- •Кондуктометрия. Кондуктометрическое титрование
- •Вольтамперометрия. Прямая полярография. Амперометрическое титрование
- •Контрольные вопросы к главе 1.3.
- •1.4. Спектральные и оптические методы анализа
- •Оптические спектры
- •Величины светопоглощения
- •Спектр поглощения
- •Выбор длины волны и светофильтра
- •Чувствительность фотоколориметрических и спектрофотометрических методов
- •Основные приемы фотометрического анализа
- •Приборы фотометрического анализа Для количественной оценки интенсивности окраски или светопоглощения применяют различные приборы:
- •Электронные спектры поглощения органических соединений
- •Типы электронных переходов
- •Инфракрасная спектроскопия
- •Устройство ик - спектрометра
- •Ядерный магнитный резонанс
- •Химический сдвиг
- •Спин-спиновое взаимодействие
- •Контрольные вопросы к теме 1.4
- •1.5. Хроматографический анализ и хромато-масс-спектрометрия хроматографические методы анализа
- •Области применения хроматографии
- •Молекулярная адсорбционная хроматография жидких веществ
- •Адсорбенты
- •Растворители
- •I. По механизму разделения
- •II. По форме проведения процесса
- •Газовая хроматография
- •Хромато-масс-спектрометрия
- •Контрольные вопросы к теме 1.5.
- •Заключение
- •Список литературы к разделу 1.1.-1.3.
- •Список литературы к разделу 1.4.-1.5.
- •Терминологический словарь к разделу 1
Основные методы титриметрического анализа. Основные приемы титрования
Методы объемного анализа классифицируются по способу (приему) титрования и по характеру химической реакции, лежащей в основе определения вещества. Классификация методов приведена на рис.2.
Классификация методов объемного анализа
1. По способу проведения титрования:
2. По характеру используемых реакций:
|
Рис.2 – Классификация методов объемного анализа |
Независимо от типа реакции, используемой для титриметрического анализа, они должны удовлетворять следующим требованиям:
1. Равновесие этих реакций должно быть сильно смещено в сторону конечных веществ, т.е. они должны быть практически необратимыми.
2. Реакции не должны сопровождаться побочными процессами и должны строго следовать закону эквивалентности.
3. Реакции, положенные в основу аналитического определения, должны протекать с достаточной скоростью.
4. Должен существовать надежный метод определения точки эквивалентности.
Метод кислотно-основного титрования (нейтрализации)
К методу кислотно-основного титрования относят все определения, в основе которых лежит реакция:
Н+ + ОН- → Н2О.
Этот метод используется для количественного определения кислот, оснований, кислых и основных солей.
Техника определения состоит в том, что к раствору основания (или кислоты) постепенно приливают из бюретки рабочий раствор кислоты (или основания) до наступления момента эквиваентности.
Количество основания (или кислоты) содержащееся в исследуемом растворе, вычисляют по объему соответствующего рабочего раствора, пошедшего на титование.
Основными рабочими растворами в этом методе являются раствор кислоты (обычно НСl, Н2SО4) и раствор щелочи (обычно NаОН или KОН).
В качестве стандартных веществ при установке титров кислот чаще всего применяют буру (Na2B4O7·10H2O) или соду; при установке титра щелочей – щавелевую кислоту (Н2С2О4·2H2O) или янтарную кислоту (Н2С2Н4О4).
Известно, что произведение концентраций ионов [H+] и [OH–] во всяком водном растворе равно (при 25°С):
[H+] [OH–]
=
![]() =
10–14
г-ион/л. (16)
=
10–14
г-ион/л. (16)
В воде и нейтральных растворах количества Н+ и ОН–-ионов должны быть равны между собой. Следовательно:
[H+] [OH–]![]() г-ион/л.
г-ион/л.
В кислых растворах [H+] [OH–], т.е. [H+] 10-7 и [OH–]˂10-7
В щелочных растворах [H+] [OH–], т.е. [OH–] 10-7и [H+]10-7
Для характеристики реакций растворов пользуются водородными и гидроксильными показателями– рН и рОН:
рН = –lg[H+] и |
pOH = –lg[OH–] |
водородный показатель |
гидроксильный показатель |
Если прологарифмировать уравнение (16) и переменить знаки логарифмов на обратные, то получим:
(–lg[H+]) + (–lg[OH–]) =14
или
рН + рОН = 14.
Величина рН в точке эквивалентности зависит от природы реагирующих веществ (кислоты и основания) и от их концентрации.
При титровании сильной кислоты (HCl) сильным основанием (NaOH) происходит:
Н+ + ОН– → Н2О.
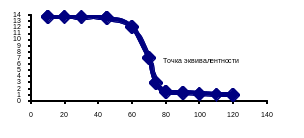
В этом случае по достижении точки эквивалентности количество прибавленного сильного основания будет эквивалентно количеству титруемой кислоты, т.е. в этот момент в растворе будет только образовавшаяся при реакции соль (NaCl) без всякого избытка кислоты или щелочи. Следовательно, и в точке эквивалентности в рассматриваемом случае рН должен равняться 7. То же будет и при титровании любой другой сильной кислоты какой – либо щелочью, а также при титровании щелочи сильной кислотой. Кривые титрования приведены на рис.3 и 4.
рН
|
рН
V(HCl), мл |
Рис.3 – Кривая титрования сильной кислоты сильным основанием |
Рис.4 – Кривая титрования сильного основания сильной кислотой |
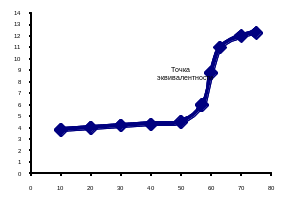
При титровании слабой кислоты (например, уксусной) сильным основанием будет происходить следующая реакция:
СН3СООН + ОН– ↔ СН3СОО– + Н2О.
В точке эквивалентности в растворе будет присутствовать соль CH3COONa, которая подвергается гидролизу:
СН3СООН + Н2О ↔ СН3СОО– + ОН–.
рН
V(NaOH), мл |
Реакция обратима и не идет до конца. Часть кислоты и щелочи останется в растворе в свободном состоянии. В точке эквивалентности количества свободных СН3СООН и NaOH эквивалентны друг другу. Но уксусная кислота как слабодиссоциированная будет отдавать в раствор мало Н+-ионов, а NaOH – наоборот, создаст большую концентрацию ОН– ионов. |
Рис.5 – Кривая титрования слабой кислоты сильным основанием |
Следовательно, заканчивать титрование нужно уже не при рН =7, а при рН7 (см. рис.5).
При титровании слабых оснований сильными кислотами, например:
NH4OH + H+ ↔ ![]() + H2O
+ H2O
рН
V(HCl), мл |
В точке эквивалентности реакция раствора определяется гидролизом , приводящим к накоплению H+-ионов. Следовательно, в этом случае рН в точке эквивалентности должен быть меньше 7 (см. рис.6). |
Рис.6 – Кривая титрования слабого основания сильной кислотой |

 V(NaOH),
мл
V(NaOH),
мл