
- •Введение
- •Глава I
- •1. Основные понятия и определения
- •§ 5. Зависимость между тепловыми эффектами Qv и Qp
- •§ 1. Объединенное уравнение первого и второго законов термодинамики
- •§ 2. Внутренняя энергия и ее частные производные
- •§ 3. Энтальпия и ее частные производные
- •§ 4. Энергия гельмгольца
- •§ 6. Термодинамические потенциалы
- •§ 7. Уравнения гиббса—гельмгольца
- •§ 9. Зависимость химического потенциала от давления и температуры
- •§ 10.Фугитивность и активность
- •§ 1. Условие равновесия фаз
- •§ 2. Правило фаз гиббса
- •§ 3. Устойчивость фаз
- •§ 4. Фазовые диаграммы
- •§ 5. Уравнение клапейрона—клаузиуса
- •§ 1. Закон действующих масс. Константы равновесия
- •§ 2. Химическое равновесие в гетерогенных реакциях
- •§ 3. Определение констант равновесия сложных химических реакций
- •§ 6. Константа равновесия и максимальная работа реакции
- •§ 7. Уравнение изотермы химической реакции
- •§ 8. Направление реакции и мера химического средства
- •§ 1. Тепловая теорема нернста
- •§ 3. Третий закон термодинамики
- •§ 4. Применение тепловой теоремы нернста к газовым системам
- •§ 5. Определение константы интегрирования в уравнениях газовых реакций
§ 6. Термодинамические потенциалы
Термодинамическим потенциалом называется характеристическая функция, убыло которой в равновесном процессе, протекающем при постоянном значении соответствующих параметров, равна максимальной полезной работе, произведенной системой. Максимальная полезная работа А'mах равна максимальной работе Amах за вычетом работы против сил внешнего давления.
Рассмотрим эти потенциалы. Воспользуемся объединенным уравнением первого и второго законов термодинамики в общем виде для обратимого процесса, в котором полная работа будет максимальной:
TdS = dU + δAmax = dU + pdV + δA’max. (114)
Если за независимые переменные принять S и V, то уравнение (114) примет вид
-dU = δA'max
или
-ΔU= А'mах, (115)
т. ё. уменьшение внутренней энергии в обратимом процессе при S и V — const равно максимальной полезной работе δAmах = δA’max, следовательно, внутренняя энергия является термодинамическим потенциалом.
Приняв за независимые переменные S и р, из уравнения (114) получим
— (dU + pdV) = δA’max или —d (U + pV) = δA'max.
Заменив (U + pV) на H, после интегрирования имеем
-ΔH= А'max p (116)
т. е. уменьшение энтальпии в обратимом процессе при S = const и р = const равно максимальной полезной работе процесса. Следовательно, энтальпия является также термодинамическим потенциалом.
Определим работу при независимых переменных V и Т. Запишем объединенное уравнение первого и второго законов термодинамики для обратимого процесса в виде
TdS =dU + δАmax,
откуда
-(dU
- TdS)=![]() ;
;
-d(U-TS)= .
После замены (U—TS) на E и интегрирования получим
-ΔF = , (117)
откуда следует, что уменьшение энергии Гельмгольца в обратимом
изохорно-изотермическом процессе равно максимальной работе.
Приняв за независимые переменные р и Т из объединенного
уравнения первого и второго законов термодинамики, получим
— (dU
+ pdV
— T
dS)
=
![]()
или
-d(U + pV-TS) = .
Заменив (U + pV) на H, а (H — TS) на G, имеем
—dG =
или
-ΔH = , (118)
откуда следует, что уменьшение энергии Гиббса в обратимом изобарно-изотермическом процессе равно максимальной полезной работе .
Из уравнений (102) и (110) следует, что в обратном изотермическом процессе изменения энергии Гельмгольца в энергии Гиббса для 1 кмоль газа
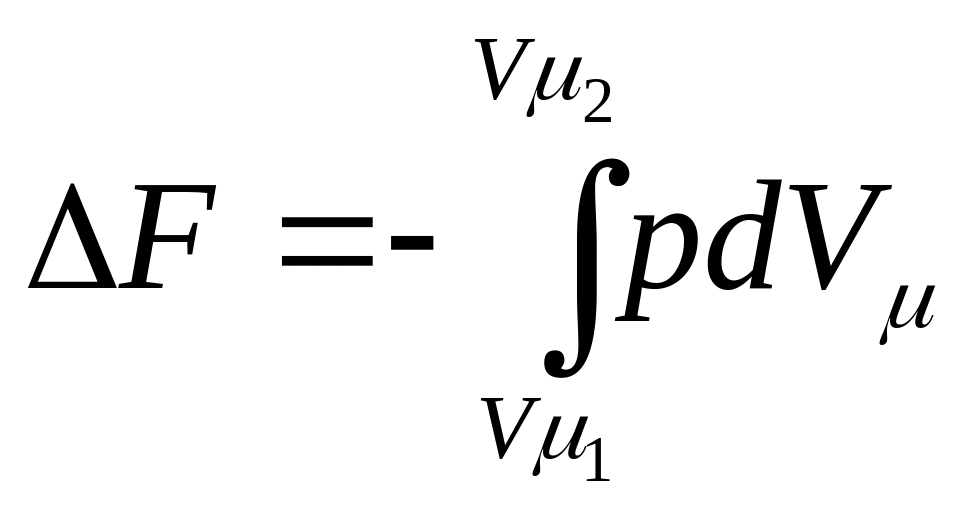
и
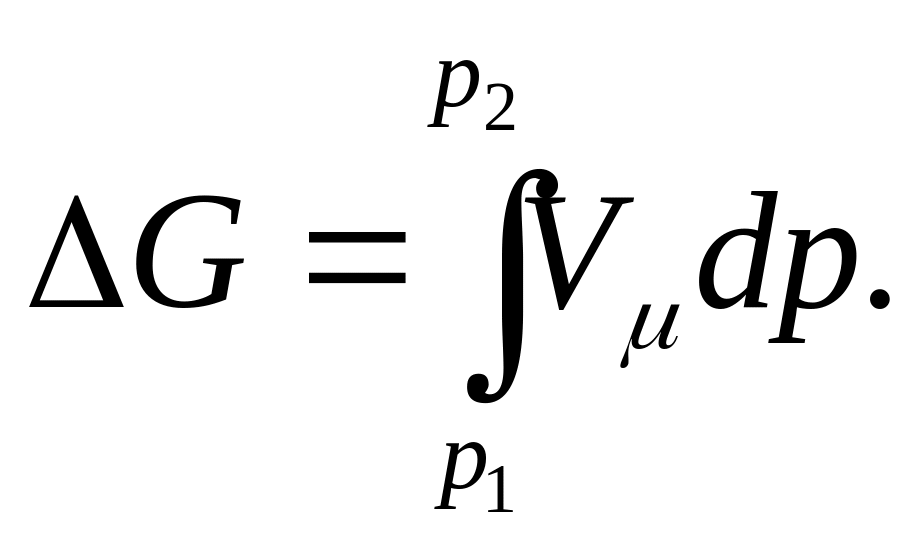
Заменив в этих выражениях р и Vμ из характеристического уравнения Менделеева—Клапейрона
pVμ = RT на соответствующие значения, получим изменение энергий Гельмгольца и Гиббса, а следовательно, и максимальной полезной работы в зависимости от давления и объема для изотермического процесса:
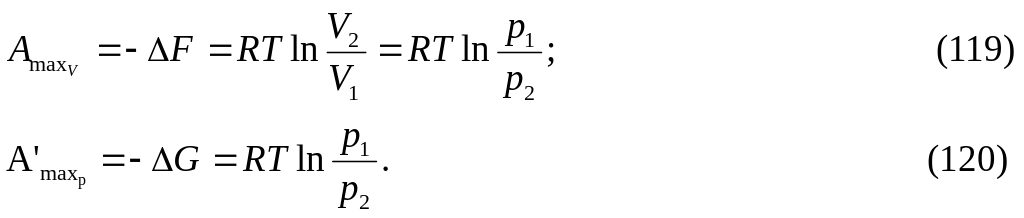 Из
уравнений (119) и (120) следует, что при
изотермическом процессе для идеального
газа изменения энергии Гельмгольца и
энергии Гиббса одинаковы, т. е. ΔF
= ΔG.
Из
уравнений (119) и (120) следует, что при
изотермическом процессе для идеального
газа изменения энергии Гельмгольца и
энергии Гиббса одинаковы, т. е. ΔF
= ΔG.
