
- •Введение
- •Глава I
- •1. Основные понятия и определения
- •§ 5. Зависимость между тепловыми эффектами Qv и Qp
- •§ 1. Объединенное уравнение первого и второго законов термодинамики
- •§ 2. Внутренняя энергия и ее частные производные
- •§ 3. Энтальпия и ее частные производные
- •§ 4. Энергия гельмгольца
- •§ 6. Термодинамические потенциалы
- •§ 7. Уравнения гиббса—гельмгольца
- •§ 9. Зависимость химического потенциала от давления и температуры
- •§ 10.Фугитивность и активность
- •§ 1. Условие равновесия фаз
- •§ 2. Правило фаз гиббса
- •§ 3. Устойчивость фаз
- •§ 4. Фазовые диаграммы
- •§ 5. Уравнение клапейрона—клаузиуса
- •§ 1. Закон действующих масс. Константы равновесия
- •§ 2. Химическое равновесие в гетерогенных реакциях
- •§ 3. Определение констант равновесия сложных химических реакций
- •§ 6. Константа равновесия и максимальная работа реакции
- •§ 7. Уравнение изотермы химической реакции
- •§ 8. Направление реакции и мера химического средства
- •§ 1. Тепловая теорема нернста
- •§ 3. Третий закон термодинамики
- •§ 4. Применение тепловой теоремы нернста к газовым системам
- •§ 5. Определение константы интегрирования в уравнениях газовых реакций
§ 2. Внутренняя энергия и ее частные производные
Примем за независимые переменные V и S. Тогда внутренняя энергия будет функцией этих переменных V =f(V, S). Так как дифференциал внутренней энергии является полным дифференциалом, то
![]() (89)
(89)
Сравнив уравнения (88) и (89), можем записать
![]() (90)
(90)
и
![]() (91)
(91)
т. е. через первые производные характеристической функции U (по переменным V и S) определяются недостающие параметры системы (90) и (91).
Вторая производная от V (S, V) дает следующее:
![]()
(так как
![]() , откуда теплоемкость при постоянном
объеме
, откуда теплоемкость при постоянном
объеме
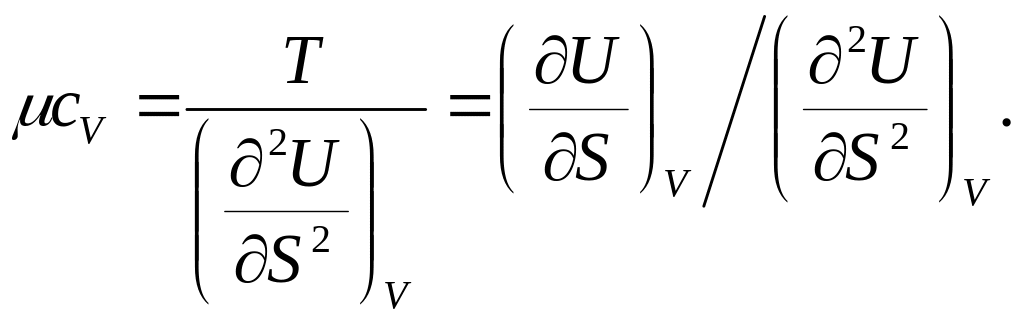 (92)
(92)
Если уравнения (90) и (91) продифференцировать вторично по другой переменной, то
![]()
Поэтому
![]() (93)
(93)
Уравнение (93) связывает термические и калорические соотношения системы.
§ 3. Энтальпия и ее частные производные
Примем за независимые переменные р и S, тогда энтальпия будет функцией переменных
Н = f (p, S). Полный дифференциал этой функции
![]() (94)
(94)
Преобразуем объединенное уравнение (88). Прибавив к обеим частям равенства Vdp, получим
dU + Vdp = TdS —pdV + Vdp
или
dU + Vdp + pdV = TdS + Vdp.
Откуда
d (U + pV) = T dS + Vdp.
Так как U + pV = H, то уравнение можно записать в виде
dH = TdS + Vdp. (95)
Сравнивая уравнения (94) и (95), находим
![]() (96)
(96)
![]() (97)
(97)
Вторая производная от Н (S, р)
![]()
(так как dS = δQpfT = μcpdTfT) откуда теплоемкость при постоянном давлении
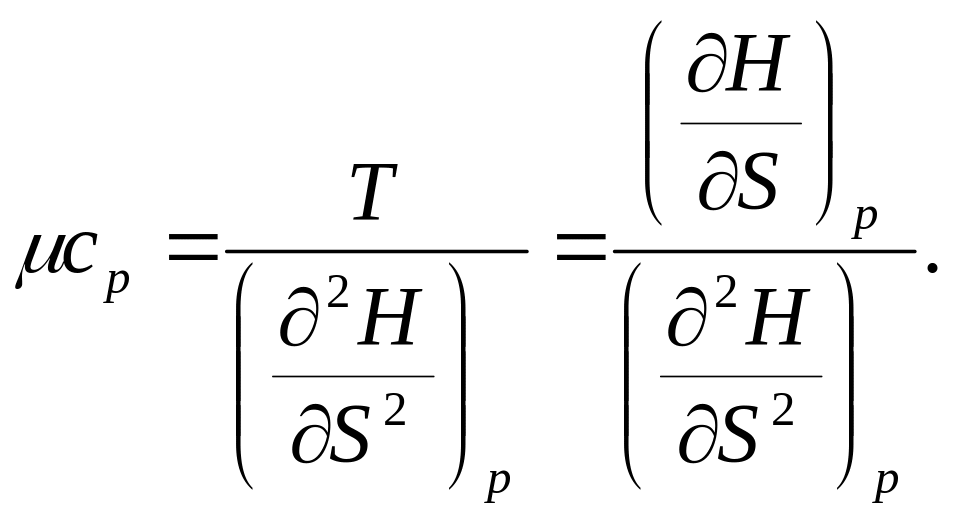 (98)
(98)
Продифференцировав вторично уравнения (96) и (97) по другой переменной, получим
![]()
откуда получаем уравнение, связывающее термические и калорические соотношения
![]() (99)
(99)
или
![]() (100)
(100)
Следовательно, через первые производные характеристической функции Н (S, р) определяются термические параметры системы по независимым переменным р и S, а через вторые — калорическая величина μcp.
