
- •Введение
- •Глава I
- •1. Основные понятия и определения
- •§ 5. Зависимость между тепловыми эффектами Qv и Qp
- •§ 1. Объединенное уравнение первого и второго законов термодинамики
- •§ 2. Внутренняя энергия и ее частные производные
- •§ 3. Энтальпия и ее частные производные
- •§ 4. Энергия гельмгольца
- •§ 6. Термодинамические потенциалы
- •§ 7. Уравнения гиббса—гельмгольца
- •§ 9. Зависимость химического потенциала от давления и температуры
- •§ 10.Фугитивность и активность
- •§ 1. Условие равновесия фаз
- •§ 2. Правило фаз гиббса
- •§ 3. Устойчивость фаз
- •§ 4. Фазовые диаграммы
- •§ 5. Уравнение клапейрона—клаузиуса
- •§ 1. Закон действующих масс. Константы равновесия
- •§ 2. Химическое равновесие в гетерогенных реакциях
- •§ 3. Определение констант равновесия сложных химических реакций
- •§ 6. Константа равновесия и максимальная работа реакции
- •§ 7. Уравнение изотермы химической реакции
- •§ 8. Направление реакции и мера химического средства
- •§ 1. Тепловая теорема нернста
- •§ 3. Третий закон термодинамики
- •§ 4. Применение тепловой теоремы нернста к газовым системам
- •§ 5. Определение константы интегрирования в уравнениях газовых реакций
§ 5. Зависимость между тепловыми эффектами Qv и Qp
Для вывода уравнения зависимости между Qv и Qp воспользуемся соотношением
Qp = ΔН = ΔUp + Δ (pV),
где ΔUp — изменение внутренней энергии термодинамической системы при осуществлении изобарного процесса. В общем случае это изменение отличается от изменения внутренней энергии в изохорном процессе, т. е. ΔUP ≠ ΔUV, так как
V≠
const.
Следовательно,
![]() .
Поэтому при замене ΔUV
на QV
уравнение (45) можно переписать так:
.
Поэтому при замене ΔUV
на QV
уравнение (45) можно переписать так:
![]() .
.
В конденсированных системах разница между Qp и Qv незначительна и можно принять, что Qp = Qv. Однако при наличии в системе газообразных веществ разница значительная.
Если принять газы идеальными, то уравнение (45) можно записать в виде
QP = Qv + pΔV= QV + pV2- pV1.
Заменив в этом выражении pV2 на n2RT и pV1 на n1RT, где n1 и п2 — числа киломолей газообразных веществ до и после реакции, из уравнения (3) получим
Qp = Qv + Δ nRT (47)
Qv = Qp-Δ nRT, (48)
где Δn — изменение числа киломолей газообразных продуктов реакции. При Δn > 0
QV < QP.
Примером такой реакции может служить реакция образования окиси углерода
2С + О2 = 2СО, в которой Δn= 2 — 1 = 1 и Qv = Qp — RT, т. е. Qv < Qp. Термодинамическая система в этом случае совершает работу расширения за счет уменьшения внутренней энергии системы.
При Δn <0 QV> Qp. Примером такой реакции могут служить реакции: СО + 0,5О2 = СО2 или Н2 + 0,5О2 = Н2О, в которых Δn = 1 — 1,5 = —0,5, т. е. Δn < 0. Тогда Qv = Qp + 0,5RT, т. е. Qv > Qp.
В этом случае над термодинамической системой совершается работа внешней средой и система получает дополнительную теплоту.
Когда Δn = 0, тепловые эффекты Qv = Qp. Примером такой реакции может быть реакция СО + Н2О = СО2 + Н2, в которой Δn = 2 — 2 = 0. Следовательно, Qv = Qp.
ЗАКОН ГЕССА
Независимость теплового эффекта реакции от промежуточных стадий химических процессов была установлена русским ученым академиком Г. И. Гессом в 1840 г. на основании экспериментальных данных. Это справедливо для реакций, протекающих при V, Т = const или р, Т = const. Такое утверждение является, по существу, законом сохранения энергии применительно к химическим реакциям. Следует заметить, что закон Гесса — основной закон химической теплодинамики был открыт еще до того, как был сформулирован первый закон термодинамики. Закон Гесса устанавливает, что тепловой эффект химической реакции не зависит от пути перехода системы из одного состояния в другое, а определяется лишь начальным и конечным ее состояниями.
Таким образом, выведенные ранее соотношения
QV =U2 -U1 и Qp =H2 - H1
являются алгебраическими выражениями закона Гесса.
Расчеты тепловых эффектов химических реакций описаны в работах М. В. Ломоносова, Лавуазье, Лапласа. Значительный экспериментальный материал был получен Г. И. Гессом, Н. Н. Бекетовым, Бертло, Томсоном, И. А. Каблуковым и другими учеными. Обширные исследования по определению тепловых эффектов химических реакций проведены В. Ф. Лугининым и его учениками.
Для определения тепловых эффектов химических реакций применяются специальные приборы — калориметры.
Закон Гесса имеет большое практическое значение, так как с его помощью можно вычислить тепловые эффекты химических реакций, экспериментальное определение которых затруднительно или практически неосуществимо. Поясним это на примере
(рис. 6).
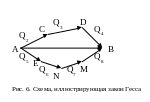
Предположим, что вещество А превращается в вещество В тремя путями: непосредственно из вещества А в вещество В с тепловым эффектом Q1; через стадии С, D с тепловыми эффектами Q2, Q3, Q4, через стадии Е, N, М с тепловыми эффектами Q5, Q6, Q7 и Q8. По закону Гесса суммарные тепловые эффекты одинаковы, поэтому
Q1=Q2+Q3+Q4;
Q1=Q5+Q6+Q7+Q8.
Тогда
Q2+Q3+Q4=Q5+Q6+Q7+Q8.
Пользуясь этими соотношениями, легко вычислить тепловой эффект любой химической реакции, который невозможно получить экспериментально. Например, тепловой эффект
Q8 =Q1-Q5-Q6-Q7.
Как правило, экспериментальное определение тепловых эффектов на всех стадиях проводится с большой тщательностью, соблюдаются все предпосылки, вытекающие из закона Гесса (условия, к которым приводятся начальные и конечные продукты сгорания, одинаковый химический состав исходных продуктов и т. д.), сведены до минимума ошибки и неточности, связанные с условиями теплообмена экспериментальной аппаратуры с окружающей средой, способами измерения температур и др., т. е. необратимые потери, связанные с превращением механической энергии непосредственно в тепловую, практически отсутствуют.
С помощью закона Гесса можно производить расчеты, используя так называемые термохимические уравнения, представляющие собой стехиометрические уравнения химических реакций, в которых наряду с химическими формулами веществ, участвующих в реакции, записываются тепловые эффекты (отнесенные к одинаковым условиям). С этими уравнениями можно производить алгебраические действия так же, как с любыми алгебраическими уравнениями.
Стехиометрическими уравнениями или соотношениями называются численные соотношения между количествами реагирующих веществ, отвечающие законам стехиометрии, основные положения которой вытекают из законов Авогадро, Гей-Люссака, постоянства состава, кратных отношений и др.
Из стехиометрического соотношения, например,
2Н2 + О2 = 2Н2О
следует, что при образовании воды на две молекулы водорода Приходится одна молекула кислорода или в общем виде
xaA+xbB=xaD, при образовании xd молекул вещества D на xа молекул вещества А требуется xb молекул вещества В. Коэффициенты ха, xb и xd — число молекул исходных веществ и полученных в реакции называются стехиометрическими коэффициентами.
Количество киломолей исходных и полученных веществ в химической реакции пропорционально стехиометрическим коэффициентам. В газовых реакциях объемы и парциальные давления реагирующих веществ и продуктов реакции также пропорциональны стехиометрическим коэффициентам.
Так как тепловые эффекты зависят от физического состояния реагирующих веществ и условий, при которых протекает реакция, то для возможности проведения термохимических расчетов, тепловые эффекты, вводимые в термохимические уравнения, должны быть отнесены к каким-то одинаковым условиям, в противном случае они несопоставимы. За такие условия принимают условия, при которых реакция осуществляется между веществами, находящимися в определенных стандартных состояниях.
За стандартные состояния индивидуальных жидких и твердых веществ принимают их устойчивое состояние при данной температуре и давлении р = 1 атм = 760 мм рт. ст., или 1,013- 105 Па, а для индивидуальных газов — такое их состояние, когда при давлении р = 760 мм рт. ст. и данной температуре они подчиняются уравнению состояния идеального газа.
Широко приводимые в справочниках тепловые эффекты обычно относят к давлению р = 1 физической атмосфере (1,013·105 Па) и температуре t = 25° С (298,15 К) и обозначают Q0V298 и Q0P298
или ΔQ0298 и ΔH0298.
Из закона Гесса вытекают следствия, имеющие большое практическое значение.
1. Тепловой эффект реакции разложения Qpaз химического соединения по величине равен и противоположен по знаку тепловому эффекту образования Qo6p этого соединения из продуктов разложения:
Qразл=-Qобр
2. Если из двух химических систем образуются одни и те же конечные продукты двумя различными путями, то разность между значениями тепловых эффектов химических реакций равна тепловому эффекту превращения одной химической системы в другую. Так, например, для реакции образования вещества В из веществ А и С (рис. 7), согласно закону Гесса,
Q1 = Q2 + Q3,
откуда тепловой эффект превращения вещества А в С
Q3= Q1- Q2
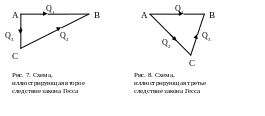
3. Если одинаковые по химическому составу системы двумя путями превращаются в различные конечные продукты, то разность между значениями тепловых эффектов, равна теплоте, полученной при превращении одного конечного продукта химической реакции в другой. Так, при образовании из вещества А веществ В и С (рис. 8), согласно закону Гесса, Q1 = Q2 + Q3 , откуда тепловой эффект перехода вещества С в вещество В
Q3 =Q1 - Q2.
При термохимических расчетах особое значение имеют два вида тепловых эффектов химических реакций: теплота образования соединений и теплота сгорания.
Теплотой образования принято называть тепловой эффект реакции образования данного соединения из соответствующих простых веществ в стандартных условиях.
За стандартное состояние простых веществ принимают их стабильное состояние при давлении, равном одной физической атмосфере (760 мм рт. ст., или 1,013- 105 Па) и температуре 298,15 К.
В качестве примера можно привести реакцию образования бензола: из веществ в стандартных состояниях —'■ твердого углерода и газообразного водорода получается жидкий бензол
6СТВ + ЗН2 = С6Н6ж.
Индексы соответственно «ж» и «тв» относятся к жидкой и твердой фазам. Индекс «г» относится к газообразному веществу, однако в расчетных уравнениях его обычно опускают.
Теплота образования, соответствующая стандартным условиям, называется стандартной. Данные по теплоте образования наряду с другими физико-химическими величинами приводятся в справочниках.
Так как при термодинамических расчетах определяют не абсолютные значения внутренней энергии и энтальпии, а их изменение, то при определении теплоты образования какого-либо соединения начало отсчёта внутренней энергии или энтальпии можно выбрать произвольно. Так, например, в справочниках Для различных простых веществ при стандартных условиях принимают, что энтальпия равна нулю. К таким веществам относятся С, Н2, О2, Cl2(г) ,F2(г) и др.
Таким образом, тепловой эффект образования соединений из этих веществ, например, Qp оказывается равным энтальпии соединения при искомых условиях.
Теплоту образования можно относить к любому количеству вещества. В справочниках, как правило, ее относят к 1 кмоль или 1 кг соединения.
В табл. 1 приведены значения теплоты образования веществ для некоторых распространенных химических соединений.
Теплота сгорания. Горение представляет собой сложное, быстро протекающее химическое превращение, сопровождающееся выделением значительного количества теплоты и, как правило, ярким свечением.
Таблица 1. Тепловые эффекты образования соединений из простых веществ при стандартных условиях
Вещество |
Q0P298= ΔH0298 ·10-6 Джfкмоль
|
Q0P298= ΔH0298·10-3 Ккалfкмоль
|
Вещество |
Q0P298= ΔH0298 ·10-6 Джfкмоль
|
Q0P298= ΔH0298·10-3 Ккалfкмоль
|
С (графит) |
0 |
0 |
С2Н4г — этилен |
52,28 |
12,492 |
Нг |
217,98 |
52,098 |
С2Н6г— этан |
—84,67 |
—20,236 |
H2г |
0 |
0 |
С3Н8г — пропан |
—103,9 |
—24,820 |
N2г |
0 |
0 |
С6Нвг — бензол |
82,93 |
19,82 |
Oг |
429,18 |
59,56 |
С6Н6ж — бензол |
49,04 |
11,718 |
OHг |
38,96 |
9,31 |
СвН12г — цикло- |
—123,1 |
—29,43 |
OH2г |
0 - |
0 |
гексан |
|
|
|
142,3 |
34,0 |
С7Н8г — толуол |
50,00 |
11,95 |
COг |
—110,5 |
—26,41 |
С7Н8ж — толуол |
8,08 |
1,93 |
CO2г |
—393,51 |
—94,05 |
C10 H8кр — нафта- |
75,44 |
18,03 |
СаСО3 (кальцит) |
—1206 |
—288,2 |
лин |
|
|
СаО (кристалл) |
—635,1 |
—151,8 |
СН4Ож — метило- |
—238,7 |
—57,05 |
Н2ОГ |
—241,84 |
—57,80 |
вый спирт |
|
|
H2Oж |
—285,84 |
—68,32 |
СН4ОГ — метило- |
—202,2 |
—48,09 |
NH3г |
—46,19 |
—11,04 |
вый спирт |
|
|
NH3ж |
—69,87 |
—16,7 |
С2Н6ОЖ — этило- |
—277,6 |
—66,35 |
NOг |
90,37 |
21,60 |
вый спирт |
|
|
NO2г |
33,89 |
8,09 |
С2НвОг — этило- |
—235,3 |
—56,24 |
N2Oг |
81,55 |
19,5 |
вый спирт |
|
|
N2O4r |
9,37 |
2,24 |
CH5Nr — метил- |
—28,03 |
—6,70 |
NaO5 |
(12,5) |
(3,06) |
амин |
|
|
CH4r — метан |
—74,85 |
—17,889 |
C2H7Nr — диметил- |
—27,61 |
—6,60 |
QH2r — ацетилен |
226,75 |
54,194 |
амин |
|
|
Рис. 9. Схема калориметрической «бомбы»:
1 – цилиндр;
2 – крышка; 3 – чашечка; 4 - спираль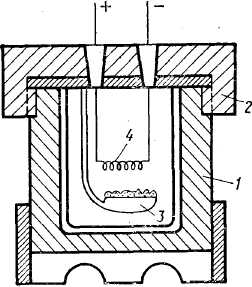
Тепловой эффект реакции горения, называемый теплотой сгорания, обычно измеряют калориметрическим способом.
Теплотой сгорания соединения называется тепловой эффект реакции окисления данного соединения кислородом с образованием предельных высших окислов соответствующих элементов. Так, например, в органических соединениях, являющихся основным топливом в тепловых двигателях, углерод окисляется до углекислого газа, водород — до водяных паров, другие вещества, входящие в соединение в незначительных количествах — до их конечных продуктов окисления.
На теплоту сгорания существенное влияние оказывают температура и давление. Для возможности использования теплоты сгорания в термохимических соотношениях ее нужно приводить к стандартным условиям. Теплота сгорания в этом случае называется стандартной. Значение теплоты сгорания, найденное по справочнику, используется для определения тепловых эффектов реакций.
На рис. 9 приведена схема калориметрической бомбы, в которой экспериментально определяют теплоту сгорания. Калориметрическая бомба представляет собой толстостенный стальной цилиндр 1, покрытый изнутри платиной. На цилиндр навинчивают крышку 2. Внутри цилиндра предусмотрена чашечка 3 для навески исследуемого вещества. В цилиндр под высоким давлением нагнетают кислород. С помощью проволочки 4, нагреваемой электрическим током, поджигают исследуемое вещество. Бомбу помещают в калориметр, посредством которого и определяют теплоту сгорания исследуемого вещества. Температуру продуктов сгорания «приводят» к температуре в бомбе до поджигания.
Теплота сгорания органических соединений, часто называемая теплотой сгорания топлива, является исходной величиной в расчетах рабочих процессов тепловых двигателей. Она определяется как количество теплоты (в Дж или ккал), выделяющееся при полном сгорании 1 кг массы, 1 м3 объема или 1 кмоль топлива.
Теплота сгорания топлива, если ее определить описанным выше способом, в калориметрической бомбе будет теплотой сгорания для процесса при V = const, т. е. это будет тепловой эффект QV.
Различают высшую и низшую теплоту сгорания топлива.
Высшей теплотой сгорания топлива QB называется полное количество теплоты, выделившееся при сгорании горючих частей топлива при условии конденсации водяных паров.
Низшей теплотой сгорания топлива QH называют разницу между полным количеством выделившейся теплоты и скрытой теплотой парообразования воды как имеющейся в топливе в виде примеси, так и получающейся в результате сгорания водорода.
Высшая QB и низшая QH теплоты сгорания топлива связаны между собой соотношением
-Qh = -QB+rb (9H + W) = -Qb + 2,512·106 (9H+W), Джfкг, (49)
где rb — скрытая теплота парообразования (для технических расчетов принято rb ≈ 2,512· 106 Джfкг); 9H — количество водяного пара, образующегося при сжигании H (кг) водорода, содержащегося в 1 кг топлива; W — количество влаги, содержащейся в 1 кг топлива, кг.
В расчетах рабочих процессов ДВС за теплоту сгорания принимают низшую теплоту сгорания, так как продукты сгорания, удаляющиеся из двигателя через выпускную систему, обычно имеют температуру, превышающую температуру конденсации содержащихся в них водяных паров.
В табл. 2 приведены значения низшей теплоты сгорания топлив.
На основании закона Гесса и его следствий можно составить термохимическое уравнение для определения теплового эффекта реакции через тепловые эффекты образования реагирующих веществ.
Так, например, если имеет место реакция bВ + dD = еЕ + gG, где В, D, Е, G, b, d,e, g — исходные вещества и продукты реакции
Таблица 2
Низшая теплота сгорания топлив
Топливо |
Молекуляр- ная масса
|
Низшая теплота сгорания |
|
μ г, кгfмоль |
Джfкг · 10-6 |
ккалfкг |
|
Бензин (элементарный состав по массе |
110—120 |
—44,0 |
—10 500 |
С = 0,855: Н = 0,145) |
|
|
|
Дизельное топливо (элементарный со- |
180—200 |
—42,50 |
—10 150 |
став по массе С = 0,870; Н = 0,126; |
|
|
|
О = 0,004) |
|
|
|
Керосин типа Т-1 |
|
—42,845 |
—10 230 |
СН4г — метан |
16,042 |
—49,80 |
—11 860 |
С3Н8г — пропан |
44,094 |
—46,05 |
—11 000 |
CH5Nr — метиламин |
31,058 |
—31,20 |
—7 446 |
СгН7Нг — этиламин |
45,084 |
—35,15 |
—8 340 |
CHeN2}K — металгидразин |
46,084 |
—25,44 |
-^-6 070 |
C2H8N2}K — несимметричный диметил- |
60,100 |
—32,90 |
—7 850 |
Гидразин |
|
|
|
и их стехиометрические коэффициенты соответственно, то тепловой эффект этой реакции
Qp=(eQобр+gQобрG) – (bQобрB+dQобрD)
Отсюда уравнение в общем виде
![]() (50)
(50)
где QобрB, QобрD, QобрE и Qo6pG —теплота образования соответственно исходных веществ и продуктов реакдии; ni — числа киломолей (от 1 до т), пропорциональные стехиометрическим коэффициентам реагирующих веществ.
Следовательно, тепловой эффект реакции равен разности теплоты образования продуктов реакции и теплоты образования исходных веществ, взятых с соответствующими стехиометрическими коэффициентами.
С помощью закона Гесса и его следствий можно также составить термохимическое уравнение для расчета теплового эффекта, если известна теплота сгорания веществ, участвующих в реакции.
В общем виде
![]()
т. е. тепловой эффект реакции равен разности между теплотой сгорания исходных веществ и теплотой сгорания продуктов реакции (с учетом их стехиометрических коэффициентов).
Это можно проиллюстрировать на примере сгорания метилового спирта СН3ОН (рис. 10). Теплота сгорания 1 кмоля метилового жидкого спирта
Q2сг = — 726,49·106 Дж/кмоль;
теплоты сгорания С в СО2 и Н2 в Н2ОЖ соответственно равны
Q'1cг = —393,51·106 Дж/кмоль;
Q"1cг = —285,84·106 Дж/кмоль;
Qlcг = —965,19 ·106 Дж/кмоль.
Рис. 10. Схема
определения теплово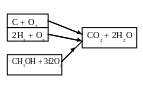 го
эффекта при сгорании метилового
спирта
го
эффекта при сгорании метилового
спирта
Запишем термохимические уравнения реакций горения:
C +O2 = CO2 + Q'1cг;
2Н2 + О2 = 2Н2ОЖ + 2Q"1cг ;
СН3ОНЖ + 1,5О2 = СО2 + 2Н2О + Q2.
Для определения теплоты образования метилового спирта из уравнения С + 2Н2 + 0,5О2 = СН3ОН + Q3 сложим два написанных выше уравнения и вычтем третье. После некоторых преобразований получим
С + 2Н2 + 0,5О2 = СН3ОН + (Qlcr - Q2cr),
сравнивая два последних уравнения, заключаем, что искомая теплота образования 1 кмоля жидкого метилового спирта
Q3обр = —238,7·106 Джfкмоль.
ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. ЗАКОН КИРХГОФА
Для определения зависимости теплового эффекта реакции от температуры продифференцируем уравнения (44) и (46):
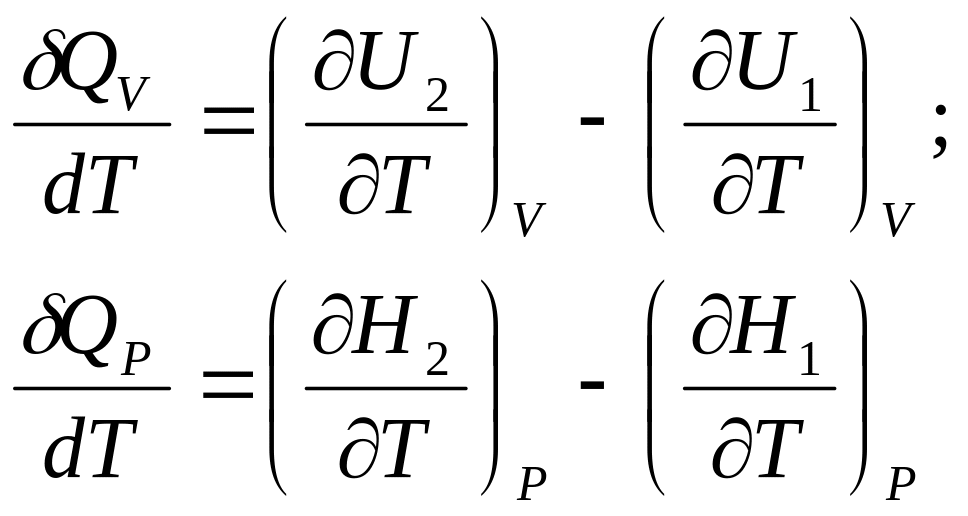 (52)
(52)
Так как выражения
![]() и
и
![]() для идеальных газов представляют собой
теплоемкости при V
= const
и р = const,
то в приведенных выше соотношениях
члены
для идеальных газов представляют собой
теплоемкости при V
= const
и р = const,
то в приведенных выше соотношениях
члены
![]() ,
,
![]() и
и
![]()
![]()
являются суммарными изохорными и изобарными киломольными теплоемкостями( μcV1 и μсV2) и (μcP1 и μcР2) системы до и после реакции.
Подставляя значения теплоемкостей в уравнения (52), можем записать
δQV/dT = μсV2 - μcV1;
δQp/dT = μcР2 - μcP1 (53)
и в общем виде
δQ/dT = μсV - μc1 = Δμc (54)
Отношения δQVfdT и δQpfdT называются температурными коэффициентами теплового эффекта изохорной и изобарной реакций соответственно.
Приведенные соотношения (53) и (54) выражают закон Кирхгофа, который устанавливает, что температурный коэффициент теплового эффекта изохорной реакции равен разности суммарных изохорных теплоемкостей продуктов реакции и исходных веществ, а температурный коэффициент теплового эффекта изобарной реакции равен разности суммарных изобарных теплоемкостей продуктов реакции и исходных веществ.
Уравнение закона Кирхгофа в интегральной форме
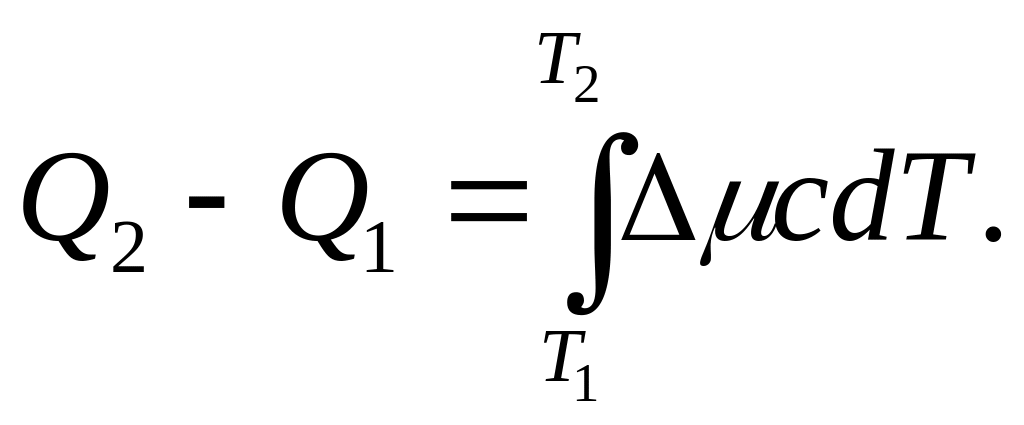
Если температуру T1 принять равной абсолютному нулю, то уравнение Кирхгофа для процессов, протекающих при V = const и р = const, можно записать так
![]()
![]()
или в общем виде
![]() (55)
(55)
где Q0 — тепловой эффект реакции при T1 = 0. Из уравнения (54) следует, что характер кривой Q = f (Т) зависит от знака приращения теплоемкостей Δμc.
Рис. 11. Зависимость теплового эффекта реакции от температуры и приращения теплоемкостей
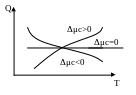
При Δμc > 0 (рис. 11) тепловой эффект реакции с повышением температуры растет, при Δμc < 0 убывает, а при Δμс = О остается постоянным.
§ 8. УРАВНЕНИЕ ВИДА Q = f (Т)
Для вывода уравнения зависимости теплового эффекта от температуры Q = f (Т) необходимо в уравнении (54) раскрыть величину Δμс. Запишем реакцию вида nbВ + ndD = пеЕ + ngG, где nb, nd, пе и ng — количества кмоль веществ В, D, Е и G.
Определим суммарные мольные теплоемкости исходных (В и D) веществ и продуктов реакции (Е и G).
Если принять зависимость теплоемкости от температуры вида (17), то суммарная теплоемкость исходных веществ
μc1=μcB+μcD,
где μcB=nb(ab+bbT+cbT2+…) и μcD=nd(ad+bdT+cdT2+…),
а суммарная теплоемкость продуктов реакции
μс2 =μcE + μcG,
где μсE = nе (ае + beT + ceT2 +…)
и μcG = ng (ag +bg Т + cgT2 +…).
Подставляя значение теплоемкостей в уравнение (54) после соответствующих преобразований получим
δQfdT = (n eae + ngag — nbab — ndad) + (nebe + ngbg — nbbb — ndbd) T+
+ (nece + ngcg — nbcb – ndcd) T2
или
![]()
откуда
![]() .
.
Проинтегрировав это выражение, найдем Q:
![]()
Если принять T = T0 ,то можно найти значение постоянной интегрирования Q0 = const. Тогда уравнение в общем виде
![]()
Обозначим
![]() .
Тогда
уравнение
Q
= f
(T)
примет окончательный вид:
.
Тогда
уравнение
Q
= f
(T)
примет окончательный вид:
Q=Q0 + αT + βT2 + γT3 + … (56)
Если принять зависимость теплоемкости от температуры как степенную функцию из уравнения (18), то после подстановки и соответствующих преобразований получим
Q = Q0 + αT + βT2- γ’fT, (57)
где γ' = Σ(nc’).
Приняв зависимость μc = f(Т) в общем виде μc =а + bТ + сT2 + с'fT2, можно, объединив уравнения (56) и (57), записать
Q = Q0 + αT + βТ2 + γT3 - γ'fT. (58)
Полученные уравнения дают возможность определять тепловые эффекты химических процессов при V = const и p = const при любой заданной температуре, если известны зависимости теплоемкостей μcv и μcp исходных веществ и продуктов реакции от температуры и тепловой эффект Q0 данной реакции. Q0 можно определить, если известен тепловой эффект данной реакции при какой-либо температуре, из соотношений
![]()
или
![]()
Тепловой эффект Q2 реакции при заданной температуре и известном Q1 при какой-либо температуре определяется по формуле, которую можно получить, решая совместно уравнения
Q1=Q0 + αT1 + βT12 +γT13
и
Q2 =Q0 + αT2 + βT22 + γT23
Вычитая из второго уравнения первое, получим
Q2 – Q1 = α(T2 – T1) + β(T22 – T12) + γ(T23 – T13). (59)
Уравнение (59) имеет большое практическое значение, так как с его помощью можно подсчитать тепловой эффект реакции для таких условий, при которых экспериментально его определить трудно или невозможно.
Важное значение для практики имеет также уравнение для подсчета теплового эффекта реакций по значениям средних теплоемкостей, изменением которых в небольших интервалах температур можно пренебречь:
![]()
откуда
![]() (60)
(60)
где μс1, μc2, Δμc — средние суммарные мольные теплоемкости исходных веществ и продуктов реакции в пределах температур от Т1 до T2, соответственно и их приращение.
ХАРАКТЕРИСТИЧЕСКИЕ ФУНКЦИИ
И ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
