
- •Введение
- •Глава I
- •1. Основные понятия и определения
- •§ 5. Зависимость между тепловыми эффектами Qv и Qp
- •§ 1. Объединенное уравнение первого и второго законов термодинамики
- •§ 2. Внутренняя энергия и ее частные производные
- •§ 3. Энтальпия и ее частные производные
- •§ 4. Энергия гельмгольца
- •§ 6. Термодинамические потенциалы
- •§ 7. Уравнения гиббса—гельмгольца
- •§ 9. Зависимость химического потенциала от давления и температуры
- •§ 10.Фугитивность и активность
- •§ 1. Условие равновесия фаз
- •§ 2. Правило фаз гиббса
- •§ 3. Устойчивость фаз
- •§ 4. Фазовые диаграммы
- •§ 5. Уравнение клапейрона—клаузиуса
- •§ 1. Закон действующих масс. Константы равновесия
- •§ 2. Химическое равновесие в гетерогенных реакциях
- •§ 3. Определение констант равновесия сложных химических реакций
- •§ 6. Константа равновесия и максимальная работа реакции
- •§ 7. Уравнение изотермы химической реакции
- •§ 8. Направление реакции и мера химического средства
- •§ 1. Тепловая теорема нернста
- •§ 3. Третий закон термодинамики
- •§ 4. Применение тепловой теоремы нернста к газовым системам
- •§ 5. Определение константы интегрирования в уравнениях газовых реакций
§ 3. Третий закон термодинамики
Выводы из положений тепловой теоремы Нернста и ее следствия выходят далеко за пределы поставленной задачи — определения константы интегрирования в уравнениях максимальной работы и константы равновесия. Эти выводы тепловую теорему обращают, по существу, в закон, который носит название третьего закона термодинамики.
В формулировке Нернста третий закон термодинамики звучит следующим образом: в любом изотермическом процессе, проведенном при абсолютном нуле температуры, изменение энтропии системы равно нулю, т. е. .
Следовательно,
ST=0 = S0 = const. (255)
Из положения тепловой теоремы Нернста о том, что энтропия конденсированной системы вблизи абсолютного нуля температуры не изменяется, следует, что в этой области не происходит теплообмена системы с окружающей средой (т. е. изотермический процесс является также и адиабатным) и что ряд функций системы, например U, H, F, G, а также μcp, μcv и др., вблизи абсолютного нуля не зависят от температуры.
Следовательно, система, еще не достигнув температуры Т = 0, приходит в такое состояние, что достижение абсолютного нуля становится практически невозможным.
Таким образом, одна из формулировок третьего закона термодинамики может быть следующей: невозможно охладить систему до температуры абсолютного нуля путем отвода тепла; абсолютный нуль недостижим.
Третий закон можно также сформулировать следующим образом: нельзя создать двигатель, который в качестве холодного источника имел бы тело с Т2 = 0 или perpetuum mobile третьего рода не осуществим,
Заметим, что высказывания и размышления о недостижимости абсолютного нуля имели место еще в работах М. В. Ломоносова..
Принимая во внимание постулат Планка, третий закон можно еще сформулировать и таким образом: энтропия любой конденсированной системы при Т = 0 К равна нулю.
Из равенства S0 = 0 следует также, что
![]() .
.
Необходимо отметить, что значение третьего закона термодинамики, особенно для исследования химических процессов, велико и вполне справедливы высказывания Нернста о том, что третий закон по своей универсальности и точности может быть вполне поставлен наряду с первым и вторым законами термодинамики.
19
§ 4. Применение тепловой теоремы нернста к газовым системам
Как было отмечено выше, тепловая теорема относится к конденсированным системам. Непосредственно к газам она неприменима. В термодинамике принято считать, что газы подчиняются законам идеальных газов, а соотношения идеальных газов не удовлетворяют тепловой теореме. Так, например, для идеального газа
п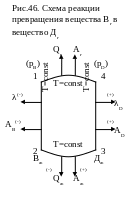 роизводная
(dp/dT)v
= R/V
при Т = 0 не обращается в нуль, в то время
как по теореме Нернста она должна
стремиться к нулю. Разность μср
— μcv
= R
при T
= 0 для газов также не обращается в нуль,
как это вытекает из тепловой теоремы.
роизводная
(dp/dT)v
= R/V
при Т = 0 не обращается в нуль, в то время
как по теореме Нернста она должна
стремиться к нулю. Разность μср
— μcv
= R
при T
= 0 для газов также не обращается в нуль,
как это вытекает из тепловой теоремы.
Однако, как показал Нернст, выводы тепловой теоремы можно использовать для расчета констант равновесия газовых реакций, если проводить их условно таким образом, чтобы конечный результат был получен на базе взаимодействия промежуточных конденсированных состояний системы, к которым тепловую теорему применять можно.
Рассмотрим простейшую реакцию превращения газообразного вещества В в газообразное вещество Д при температуре Т = const. Начальные парциальные давления газов (рис. 46) будут РB и PD, теплота реакции Q и максимальная работа газа А'max.Проведем эту реакцию в три приема. Превратим газ В при Т = const и давлении РB в жидкое состояние Вж. При этом выделится скрытая теплота испарения λB, на процесс конденсации затрачена работа А'maxB Затем жидкое вещество Вж превратим в жидкое вещество Дж, здесь выделится теплота Qж и будет произведена работа А'maxж. После этого жидкое вещество Дж превратим в газообразное Дг при Т = const и давление его доведем до начального PD. При этом будет затрачена теплота λD на испарение и произведена работа А'max д
Согласно первому и второму законам термодинамики теплота и максимальная работа реакции при изотермическом процессе не зависят от характера реакции. Поэтому для кругового изотермического процесса сумма работ и теплоты должна быть равна 0. Для суммарного процесса превращения вещества ВГ в вещество Дг теплота Qг и максимальная полезная работа могут быть определены как алгебраическая сумма теплоты и работ трех промежуточных стадий:
—Qг= λB — Qж + λD; (256)
![]() (257)
(257)
Для нахождения
работ А'max
B
и
А'max
D
рассмотрим приведенные выше процессы
в pVμ-координатах
(рис. 47). При изотермическом сжатии,
соответствующем линии 1 — K,
газ сжимается до состояния сухого
насыщенного пара от объема
![]() и давление меняется от Рв
до рв.
В результате сжатия при изобарном
процессе, соответствующем линии К — 2
газ В превращается
и давление меняется от Рв
до рв.
В результате сжатия при изобарном
процессе, соответствующем линии К — 2
газ В превращается
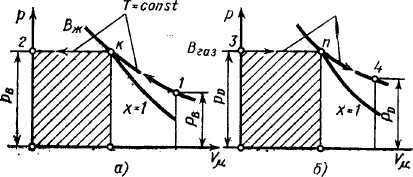
Рис. 47. Изменение параметров вещества при его конденсации (а) и испарении (б) в рVμ- координатах
в жидкое вещество
Вж
с объемом
![]() .
Таким образом, если объемом жидкости
пренебречь,
то вся работа
.
Таким образом, если объемом жидкости
пренебречь,
то вся работа
![]() .
.
Заменив из характеристического уравнения pB Vμk на RT, получим
![]() .
.
Аналогично найдем работу испарения вещества Dж и превращения его в газообразное состояние рг:
![]() .
.
Подставляя в уравнение максимальной работы (257) А'B и A'D, получим
![]() .
.
Согласно уравнению изотермы реакции (209) работу А'max г можно представить в виде
![]() .
.
Приравняем правые части полученных относительно А' г уравнений:
![]()
Следовательно,
![]() (258)
(258)
где А max
ж
—максимальная работа, совершаемая при
превращении жидкого вещества Вж
в жидкое вещество Dж,
а
![]() и pD
— давления насыщенных паров над
жидкими веществами Вж
и Dж,
которые определяются по уравнению
упругости пара. Таким образом, исходя
из положений тепловой теоремы получено
уравнение, которое можно применить
для любых реакций между газами.
и pD
— давления насыщенных паров над
жидкими веществами Вж
и Dж,
которые определяются по уравнению
упругости пара. Таким образом, исходя
из положений тепловой теоремы получено
уравнение, которое можно применить
для любых реакций между газами.
При нахождении Кр работа А'maxж формуле определяется из соотношения (248), выведенного с учетом тепловой теоремы, а давления рв и pD — из уравнения упругости пара в соответствии с уравнением (177)
![]()
где λ — теплота испарения; J' — константа интегрирования.
Константа интегрирования является величиной, характеризующей данный газ и не зависящей от вида реакции. Ее обычно называют истинной химической константой.
20
