
- •Введение
- •Глава I
- •1. Основные понятия и определения
- •§ 5. Зависимость между тепловыми эффектами Qv и Qp
- •§ 1. Объединенное уравнение первого и второго законов термодинамики
- •§ 2. Внутренняя энергия и ее частные производные
- •§ 3. Энтальпия и ее частные производные
- •§ 4. Энергия гельмгольца
- •§ 6. Термодинамические потенциалы
- •§ 7. Уравнения гиббса—гельмгольца
- •§ 9. Зависимость химического потенциала от давления и температуры
- •§ 10.Фугитивность и активность
- •§ 1. Условие равновесия фаз
- •§ 2. Правило фаз гиббса
- •§ 3. Устойчивость фаз
- •§ 4. Фазовые диаграммы
- •§ 5. Уравнение клапейрона—клаузиуса
- •§ 1. Закон действующих масс. Константы равновесия
- •§ 2. Химическое равновесие в гетерогенных реакциях
- •§ 3. Определение констант равновесия сложных химических реакций
- •§ 6. Константа равновесия и максимальная работа реакции
- •§ 7. Уравнение изотермы химической реакции
- •§ 8. Направление реакции и мера химического средства
- •§ 1. Тепловая теорема нернста
- •§ 3. Третий закон термодинамики
- •§ 4. Применение тепловой теоремы нернста к газовым системам
- •§ 5. Определение константы интегрирования в уравнениях газовых реакций
§ 6. Константа равновесия и максимальная работа реакции
Экспериментально установлено, что возникновение и интенсивность протекания химических реакций зависит от способности различных веществ взаимодействовать между собой.
Способность данных веществ вступать в химическое взаимодействие с образованием новых веществ называют химическим сродством. За меру химического сродства долгое время по предложению Бертло (1867 г.) принимали количество теплоты, выделенной при реакции. Однако по мере накопления в термохимии экспериментальных данных были обнаружены также реакции, протекающие с поглощением теплоты и реакции, которые при одних условиях их проведения выделяют, а при других — поглощают теплоту. В связи с этим за меру химического сродства принимают максимальную полезную работу реакции, т. е. работу, которая происходит при обратимом протекании данного процесса без учета работы, затрачиваемой на преодоление сил внешнего давления. Максимальная полезная работа при протекании реакции при V = const и р = const равна соответственно изменениям энергии Гельмгольца AmaxV = F1—F2 и энергии Гиббса А'таxр = G1—G2. Это положение было высказано Гиббсом (1878 г.), Гельмгольцем (1884 г.), Вант Гоффом (1884 г.) и другими учеными.
16
§ 7. Уравнение изотермы химической реакции
Запишем уравнение, полученное по методу Вант Гоффа, для реакции типа
bВ + dD ←→ еЕ + gG.
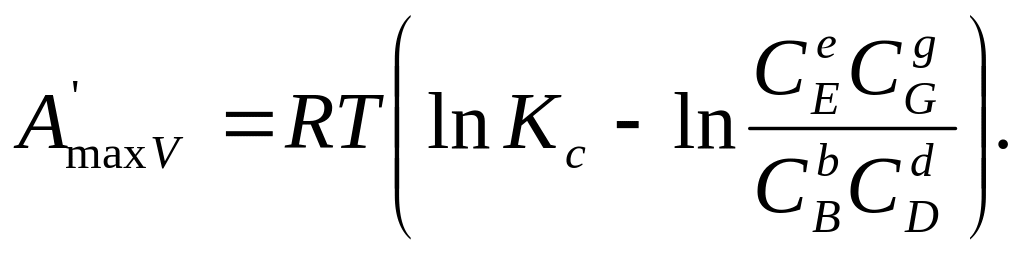 (206)
(206)
Заменив в уравнении (206) концентрации через парциальные давления (С = P/RT), а константу равновесия Кс через Кр, получим
A'maxV
= RT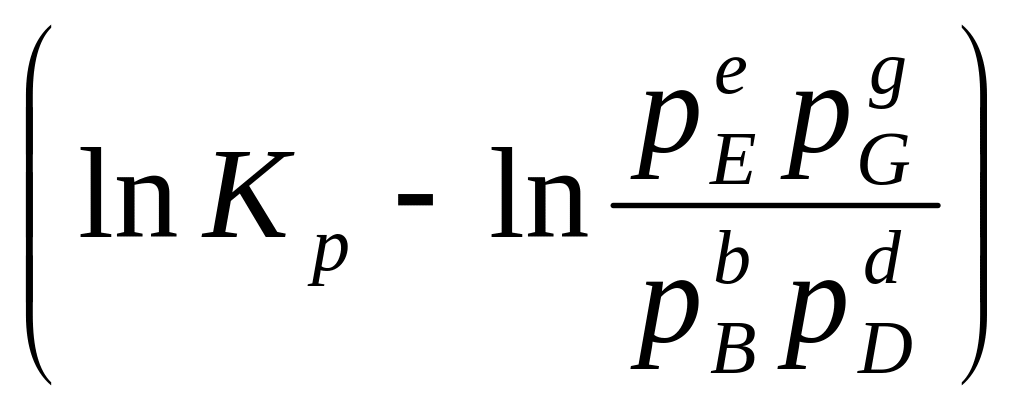 .
(207)
.
(207)
Для изобарно-изотермических реакций (р = const и Т= const) уравнения максимальной полезной работы выводятся аналогично уравнениям (206) и (207):
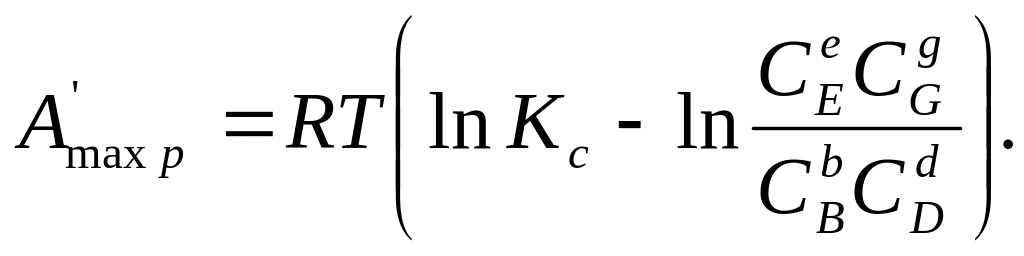 ;
(208)
;
(208)
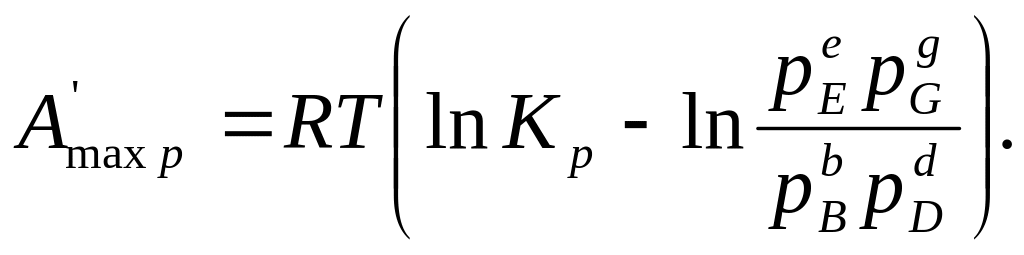 (209)
(209)
Однако A'maxV ≠ A'maxp, так как протекание реакций различно.
Максимальная полезная работа для гетерогенных реакций определяется по уравнениям (206)—(209), однако в этих уравнениях не учитываются концентрации и парциальные давления веществ, находящихся в жидком и твердом состояниях.
Учитывая, что А'mахV = —ΔF, а А'mахр = —ΔG, приведенные выше уравнения можно записать через уравнения (117) и (118):
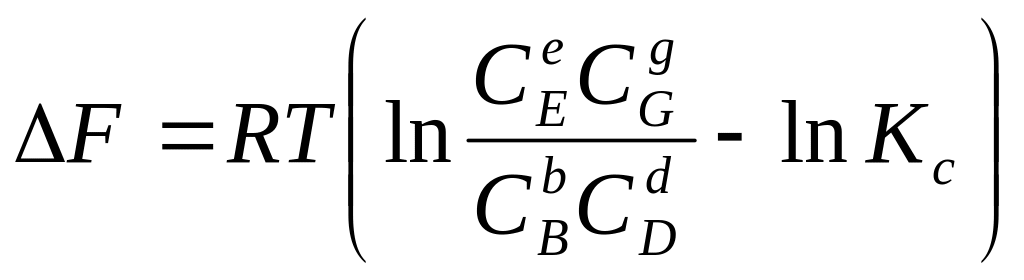 (210)
(210)
и
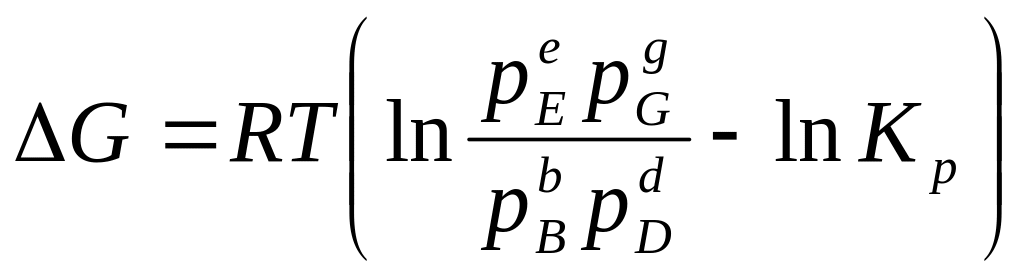 .
(211)
.
(211)
Уравнения (210) и (211), связывающие максимальную полезную работу реакции и энергии Гельмгольца и Гиббса с константами равновесия и начальными концентрациями веществ, участвующих в реакции, или их парциальными давлениями, называются уравнениями изотермы химической реакции (или уравнениями Вант-Гоффа).
