
- •Введение
- •Глава I
- •1. Основные понятия и определения
- •§ 5. Зависимость между тепловыми эффектами Qv и Qp
- •§ 1. Объединенное уравнение первого и второго законов термодинамики
- •§ 2. Внутренняя энергия и ее частные производные
- •§ 3. Энтальпия и ее частные производные
- •§ 4. Энергия гельмгольца
- •§ 6. Термодинамические потенциалы
- •§ 7. Уравнения гиббса—гельмгольца
- •§ 9. Зависимость химического потенциала от давления и температуры
- •§ 10.Фугитивность и активность
- •§ 1. Условие равновесия фаз
- •§ 2. Правило фаз гиббса
- •§ 3. Устойчивость фаз
- •§ 4. Фазовые диаграммы
- •§ 5. Уравнение клапейрона—клаузиуса
- •§ 1. Закон действующих масс. Константы равновесия
- •§ 2. Химическое равновесие в гетерогенных реакциях
- •§ 3. Определение констант равновесия сложных химических реакций
- •§ 6. Константа равновесия и максимальная работа реакции
- •§ 7. Уравнение изотермы химической реакции
- •§ 8. Направление реакции и мера химического средства
- •§ 1. Тепловая теорема нернста
- •§ 3. Третий закон термодинамики
- •§ 4. Применение тепловой теоремы нернста к газовым системам
- •§ 5. Определение константы интегрирования в уравнениях газовых реакций
§ 3. Определение констант равновесия сложных химических реакций
Константы равновесия сложных химических реакций в соответствии с законом Гесса определяют путем комбинирования более простых реакций. Комбинирование осуществляют таким образом, чтобы из их констант, обычно известных и приводимых в таблицах, можно было составить константы более сложных реакций или получить по известным константам неизвестные.
Пример.
Дана реакция С
+ О2
←→
СО2.
Определим константу равновесия этой
реакции
![]() через константы равновесия двух других
реакции:
через константы равновесия двух других
реакции:
С + 0,5О2
←→
СО;
![]()
и
СО + 0,5О2
←→
СО2;
![]()
Перемножив значения констант К'р и К''р, получим
![]()
Таким образом, константа первой реакции Кр равна произведению констант двух других реакций: Кр = K'рК"р
Пример.
Рассмотрим реакцию образования окиси
углерода СTB
+ Н2О
←→
СО + Н2
и определим константу равновесия этой
реакции
![]() через константы равновесия двух других
реакций:
через константы равновесия двух других
реакций:
CTB + 0,5O2 ←→CO;
Н2
+ 0,5O2
←→H2O;
![]()
Поделив константу равновесия К'р на К''р, получим
![]()
Отсюда
Kp = K'p/K''p
Пример. Рассмотрим реакцию образования метана из углерода и водорода
2H2
+ C ←→CH4;
![]()
и найдем константу равновесия этой реакции через константы равновесия реакций:
Н2
+ 0,5О2
←→
Н2О(Ж);
![]()
C
+ O2
←→CO2;
![]()
CH4
+ 2O2
←→CO2
+ 2H2O(ж)
;
![]()
Возведя в квадрат константу первой реакции К'p, умножив ее на константу второй реакции К''р и поделив на константу третьей реакции К'''р, получим искомую константу
Kp = (K'p)2 · (K''p/K'''p).
Пример. Определить константу равновесия реакции образования метана из окиси углерода и водорода
2СО + 2Н2
←→
СН4
+ СО2;
![]() через
константы равновесия реакций:
через
константы равновесия реакций:
2Н2
+ СО2
←→
СН4
+ O2
;
![]()
2СО + О2
←→
2СО2;
![]() ,
,
Перемножив константы К'р и К''p получим
![]() ,
,
т.е. Kp = K'pK''p
Пример. Рассмотрим реакцию образования углекислоты
СО+Н2О
←→
СО2
+ Н2;
![]() .
Через
константы равновесия более простых
реакций
.
Через
константы равновесия более простых
реакций
2CO
+ O2
←→
2CO2
;
![]()
2H2
+ O2
←→
2H2O;
![]()
определим искомую константу Кp
Для этого поделим значения констант К'р и К"р одно на другое, из полученного выражения извлечем квадратный корень
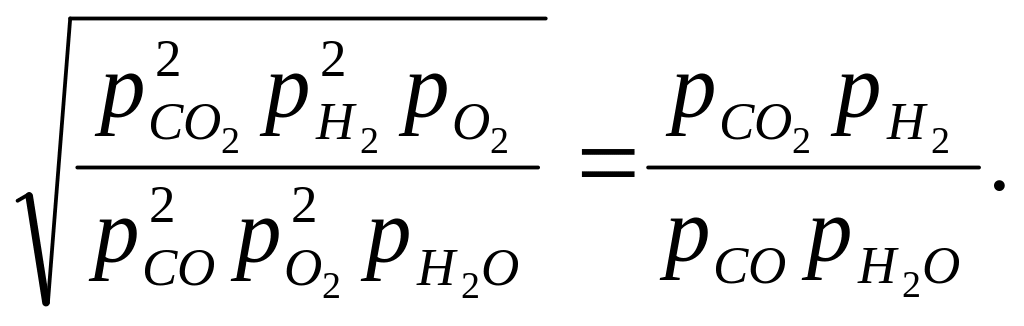
Отсюда
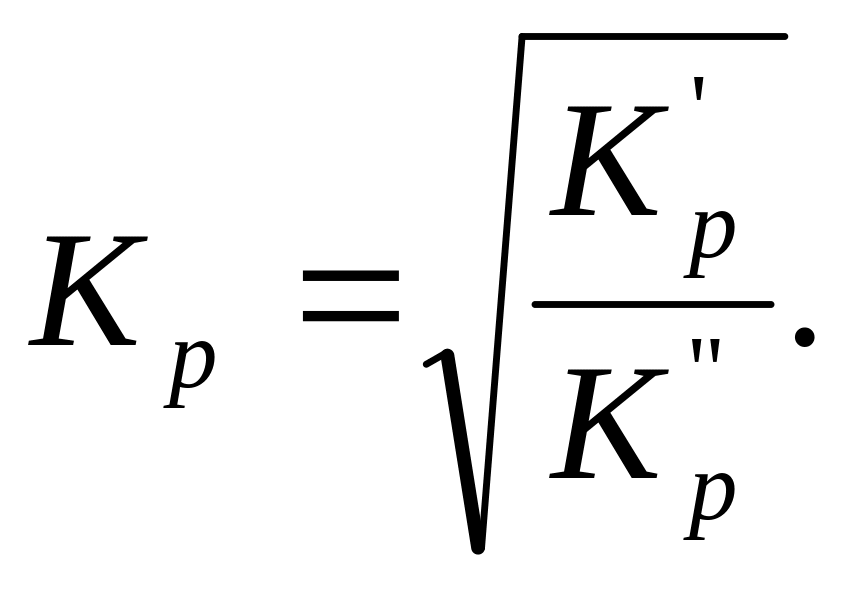
Таким образом, для отыскания численного значения неизвестной для данной реакции константы равновесия можно использовать известные значения констант других реакций, производя с ними различные алгебраические действия.
14
ОПРЕДЕЛЕНИЕ СОСТАВА СМЕСИ ПРИ ХИМИЧЕСКОМ РАВНОВЕСИИ
По константам равновесия реакций, значения которых для принятых условий приведены в таблицах, можно сравнительно легко рассчитать состав смеси при химическом равновесии данной реакции. Для этого находят из таблиц константу равновесия (Кс или Кp), соответствующую данной реакции и выбранному температурному режиму, а затем записывают уравнение равновесия по концентрациям или по парциальным давлениям; при этом предполагают, что к моменту равновесия прореагировала Х-я доля киломоля какого-либо исходного вещества. В соответствии со стехиометрическим уравнением реакции прореагирует определенная доля другого исходного вещества и образуются в соответствующих количествах продукты реакции.
Концентрации или парциальные давления определяют по количествам исходных и полученных веществ, взятых, например, в долях киломолей исходного вещества. Из составленного уравнения находят Х-ю долю и по ней определяют состав смеси.
Определим состав равновесной газовой смеси по реакции образования СО2:
СО + Н2О ←→ СО2 + H2
Предположим, что для выбранного температурного режима для данной реакции Кс= 1. К моменту равновесия прореагировала Х-я доля киломоля СО и, следовательно, Х-я доля киломоля Н2О. По известным значениям продуктов реакции СО2 и Н2О (по X долей киломоля) находим и состав смеси в долях киломоля вещества:
СО —(1 — X).
Н2О — (1 — X); СО2 — X; Н2 — X.
Приняв общий объем смеси за V (м3), найдем через концентрации газов константу равновесия
![]() XXVV/VV(1-X)(1-X)=X2/(1-X)2
Подставив в уравнение Кс
= 1, определяем X:
XXVV/VV(1-X)(1-X)=X2/(1-X)2
Подставив в уравнение Кс
= 1, определяем X:
1 =Х2\(1 —X)2,
откуда X = 0,5.
По значению X находим состав смеси.
Таким образом, к моменту равновесия состав смеси (в кмоль) следующий: СО = 0,5; Н2О = 0,5; СО2 = 0,5; Н2 = 0,5.
Пример. Реакция образования йодистого водорода H2 + J2 ←→ 2HJ протекает в сосуде объемом V = 1 м3 при температуре Т = 693 К. Константа равновесия при этих условиях Кc = 50,25.
Определить состав смеси при равновесии, если известно, что в начале реакции было 0,746 кг иода и 0,0162 кг водорода.
Константы равновесия:
![]()
![]() .
.
Обозначая так же, как и ранее степень диссоциации СО2, через а, найдем состав газа (в кмолях) при химическом равновесии:
СО2 - (1 - а)
О2 —а_________
В с е г о 1
Определив концентрации (при общем объеме V)
Ссо2 =(1 - a)/V;.
Co2 = α/V, получим
Кс =α /(1 - α).
Для этой реакции Δn = 1 — 1 =0. Тогда из уравнения (189)
Кр =Кc =α /(1 - α). (205)
Из уравнения (205) очевидно, что в реакциях, происходящих без изменения числа киломолей (при Т = const), степень диссоциации α не зависит от давления и объема.
15
