
- •Введение
- •Глава I
- •1. Основные понятия и определения
- •§ 5. Зависимость между тепловыми эффектами Qv и Qp
- •§ 1. Объединенное уравнение первого и второго законов термодинамики
- •§ 2. Внутренняя энергия и ее частные производные
- •§ 3. Энтальпия и ее частные производные
- •§ 4. Энергия гельмгольца
- •§ 6. Термодинамические потенциалы
- •§ 7. Уравнения гиббса—гельмгольца
- •§ 9. Зависимость химического потенциала от давления и температуры
- •§ 10.Фугитивность и активность
- •§ 1. Условие равновесия фаз
- •§ 2. Правило фаз гиббса
- •§ 3. Устойчивость фаз
- •§ 4. Фазовые диаграммы
- •§ 5. Уравнение клапейрона—клаузиуса
- •§ 1. Закон действующих масс. Константы равновесия
- •§ 2. Химическое равновесие в гетерогенных реакциях
- •§ 3. Определение констант равновесия сложных химических реакций
- •§ 6. Константа равновесия и максимальная работа реакции
- •§ 7. Уравнение изотермы химической реакции
- •§ 8. Направление реакции и мера химического средства
- •§ 1. Тепловая теорема нернста
- •§ 3. Третий закон термодинамики
- •§ 4. Применение тепловой теоремы нернста к газовым системам
- •§ 5. Определение константы интегрирования в уравнениях газовых реакций
§ 3. Устойчивость фаз
Равенство химических потенциалов характеризует фазовое равновесие и, следовательно, устойчивость фаз.
Рассмотрим две фазы одной системы, находящиеся при одной и той же температуре. Химические потенциалы обеих фаз являются функциями давления и графически в системе координат μp представят собой в соответствии с соотношением (дG/дp)T = V кривые с положительным угловым коэффициентом (рис. 25). Из рис. 25 следует, что кривые μi' = f (р) и μi" = f (р) при Т = const пересекаются в точке А, где общее для двух μ давление равно давлению рμ равновесного перехода, соответствующему данной температуре. Система представляет собой смесь двух фаз, находящихся в равновесии. При той же температуре, но при давлении большем, чем рμ , вторая фаза обладает большим химическим потенциалом, чем первая и, наоборот, при давлении меньшем рФП большим химическим потенциалом обладает первая фаза.
При р > рФП устойчивому равновесию системы соответствует переход вещества из фазы с большим химическим потенциалом (вторая фаза) в фазу с меньшим химическим потенциалом (первая фаза). Соответственно при р < рФП вещество будет переходить из первой фазы во вторую. Таким образом, наиболее устойчивой при данных условиях является фаза, у которой химический потенциал меньше.
Рис. 25. Зависимость химического потенциала при Т = const от давления
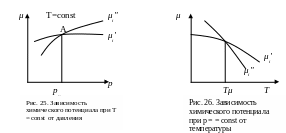
Предположим, что система состоит из двух фаз, давление которых одинаково. Тогда химические потенциалы обеих фаз являются функциями температуры μi' = f (Т) и μi" = f (Т), и в системе координат μiT эти зависимости согласно соотношению μi = (dG/dT)p = —S характеризуются двумя кривыми (рис. 26) с отрицательным угловым коэффициентом. Точка пересечения этих кривых соответствует условиям фазового равновесия системы. Температура Тμ, соответствующая данному давлению, является общей для обеих фаз. При температурах, больших температуры Тμ, наиболее устойчивой является вторая фаза с меньшим химическим потенциалом и, наоборот, при температурах, меньших Тμ, наиболее устойчивой является первая фаза.
Из рассмотренных зависимостей двух систем при р = const и Т = const следует, что при более высоких давлениях устойчивой является фаза с меньшим объемом, а при более высоких температурах устойчивая фаза образуется с поглощением теплоты. Полученные выводы представляют собой так называемый принцип смещения равновесий или принцип Ле-Шателье Брауна. Он формулируется так: внешнее воздействие, выводящее систему из состояния равновесия, вызывает в системе процессы, стремящиеся ослабить эффект этого воздействия.
Действительно, в рассмотренных случаях изменение параметров, определяющих равновесие гетерогенной системы (р и Т), ведет к такому изменению входящих в систему фаз, которое стремится препятствовать изменению данного параметра. Так, уменьшение объема препятствует повышению давления, а поглощение теплоты препятствует повышению температуры.
§ 4. Фазовые диаграммы
Фазовые превращения можно представить графически в р—Т-, р—V- и Т—s- координатах.
Если изобразить в р—Т- координатах фазовое равновесие вещества, находящегося в твердом, жидком и газообразном состояниях, то координатная плоскость разобьется на три характер-
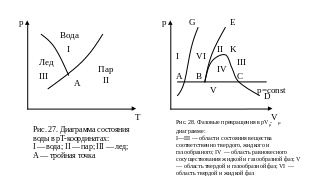
ные области. Рассмотрим в качестве примера кривые фазового перехода воды (рис. 27). Область I (вода) характеризует жидкое состояние вещества, область II (пар) — парообразное, область III (лед) —твердое. Фазовый переход вещества из твердого состояния в жидкое называется плавлением, в газообразное — возгонкой или сублимацией. Обратные им процессы называются отвердеванием или кристаллизацией и десублимацией. Фазовый переход вещества из жидкого состояния в пар называется парообразованием, обратный ему процесс — конденсацией. Точка пересечения трех кривых фазового равновесия называется тройной точкой. В этой точке вещество одновременно находится в трех фазах. Каждое вещество в тройной точке имеет свои параметры. Давление и температура в тройной точке для воды равны р =610,6 Па, Т = = 273,16 К.
Фазовая диаграмма вещества, построенная в р—V-координатах, характерна тем, что область равновесия двух фаз изображена не одной линией (как в р—Т-координатах), а представляет собой соответствующие площади диаграммы, разделенные линиями, которые называются пограничными кривыми. На рис. 28 приведена фазовая диаграмма вещества в р—Vμ -координатах. На диаграмме область I характеризует твердое состояние, область II —жидкое состояние, а область III —газообразное состояние вещества. Область IV соответствует равновесному сосуществованию жидкой и газообразной фаз вещества. Массовая доля пара, обозначаемая через х, называется степенью сухости, а массовая доля жидкости, обозначаемая через у, называется степенью влажности. Область V характеризует твердую и газообразную фазы, область VI — твердую и жидкую фазу вещества.
Отрезок изобары АС в этой диаграмме соответствует равновесию всех трех фаз, точка К — критической точке данного вещества.
T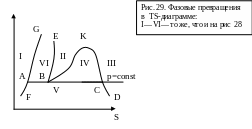
Область IV ограничена пограничной кривой ВКС. Кривая ВК называется нижней пограничной кривой или линией кипящей жидкости. В каждой точке этой кривой жидкость находится в равновесии со своим насыщенным паром, массовая доля жидкости
равна единице (у = 1). Насыщенным паром называется пар, находящийся в равновесном состоянии с жидкостью, из которой он образуется.
Отрезок КС — верхняя пограничная кривая или линия сухого насыщенного пара. В каждой точке этой кривой массовая доля пара равна единице (х = 1). Точка пересечения верхней и нижней пограничных кривых называется критической точкой, определенной для каждого данного вещества,, т. е. точкой, соответствующей критическому состоянию вещества. Критическое состояние возникает при исчезновении различия между фазами, находящимися в равновесии, например между жидкостью и ее паром. Параметры в этой точке также называются критическими (Тк, рк, VμК). При температурах больше Tк фазового превращения жидкости в пар или конденсации пара в жидкость происходить не может.
Для воды значения критических параметров следующие: Рк = = 221,29·105 Па, TК =647,3 К, VμК=0,05768 м3/кмоль. На рис. 29 приведена фазовая диаграмма, построенная в Т—s-координатах. Здесь пограничные кривые и области, соответствующие равновесному состоянию различных фаз, обозначены теми же буквами и цифрами, что и в р—vμ -координатах (см. рис. 28).
