
- •Міністерство освіти і науки україни національний університет харчових технологій
- •Курсова робота
- •Реферат
- •Аналітичний огляд літератури Розділ 1. Значення вітамінів у життєдіяльності людини
- •Вплив вітамінів на біохімічні процеси в організмі
- •Галузі застосування та потреба на ринку
- •Розділ 2. Методи одержання та промислові способи виробництва ергостерину
- •Джерела одержання ергостерину
- •Вплив основних факторів і параметрів на процес біосинтезу ергостерину
- •Технологічна частина роботи Розділ 3. Характеристика кінцевого продукту біосинтезу – ергостерину (попередника вітаміну d2)
- •Фармакологічні властивості.
- •Розділ 4. Обгрунтування вибору технологічної схеми
- •Обґрунтування вибору біологічного агента
- •Обґрунтування вибору складу поживного середовища
- •Обрахунок складу поживного середовища
- •Розрахунок вмісту в середовищі джерела вуглецевого живлення
- •Розрахунок вмісту в середовищі джерела азотного живлення
- •Розрахунок вмісту джерела фосфору в середовищі
- •Склад поживного середовища для культивування продуцента ергостерину
- •Обгрунтування способу проведення біосинтезу
- •Обгрунтування вибору ферментаційного обладнання
- •Обладнання для культивування Ферментери для глибинного культивування мікроорганізмів на рідких живильних середовищах
- •Ферментатори із пневматичним перемішуванням середовища
- •Розділ 5. Характеристика біологічного агента
- •5.1. Морфолого-культуральні ознаки Saccharomyces cerevisiae
- •5.2. Фізіолого-біохімічні ознаки
- •5.3. Таксономічний статус
- •5.4. Схема біотрансформації ростового субстрату в ергостерин
- •5 31 ,7,24(28)-Ергостатриенол
- •5 32 ,7,22,24(28)-Ергостатетраенол
- •Розділ 6. Опис технологічного процесу біосинтезу ергостерину
- •Розрахунок кількості стадій підготовки посівного матеріалу
- •Опис технологічного процесу
- •6.3. Контроль виробництва
- •Методики визначення
- •Список літератури
5.2. Фізіолого-біохімічні ознаки
Дріжджі є хемоорганогетеротрофами, використовують органічні сполуки як джерело вуглецю та енергії. Ростуть як за присутності кисню, так і без нього, тобто є факультативними анаеробами. Факультативні анаероби можуть переключатися з дихання (за присутності кисню) на бродіння (якщо кисень відсутній). На відміну від бактерій, серед дріжджів немає облігатних анаеробів, що гинуть за наявності кисню в середовищі. При пропусканні повітря через зброджуваний субстрат, в дріжджів припиняється процес бродіння і починається процес дихання (оскільки це більш ефективно), споживання кисню і виділення вуглекислого газу. Це прискорює ріст дріжджових клітин (ефект Пастера). Але навіть при доступі кисню у разі високого вмісту глюкози в середовищі дріжджі починають її зброджувати (ефект Кребтрі) [35].
Дріжджі вимогливі до умов середовища. В анаеробних умовах дріжджі можуть використовувати як джерело енергії тільки вуглеводи, причому в основному гексози і побудовані з них олігосахариди. В аеробних умовах коло засвоєних субстратів ширший: крім вуглеводів жири, вуглеводні, ароматичні і одновуглецеві сполуки, спирти, органічні кислоти. Значно більше видів здатні використовувати пентози в аеробних умовах. Складні сполуки (лігнін, целюлоза) для дріжджів недоступні.
Джерелами азоту для всіх дріжджів можуть бути солі амонію, приблизно половина видів має нітратредуктазу і може засвоювати нітрати. Шляхи засвоєння сечовини в аскоміцетних і базидіоміцетних дріжджів різні. Аскоміцетні спочатку карбоксилюють її, потім гідролізують. Базидіоміцетні відразу ж гідролізують уреазою.
Відомо, що дріжджі Saccharomyces cerevisiae мають здатність зброджувати цукор при недостачі кисню в середовищі і окиснювати ті ж цукри в циклі дихання при достатній кількості кисню. Вони зброджують і засвоюють глюкозу, галактозу, сахарозу, мальтозу, частково рафінозу і прості декстрини солодового сусла, не зброджують і не засвоюють лактозу, пентози (ксилозу і арабінозу), крохмаль, клітковину. Джерелом азотного живлення є амінокислоти і амонійні солі. Оптимальна температура розвитку 30 °С. Дріжджі даного виду добре переносять кислотність середовища до 10 – 12 °Н. Оптимальне значення рН для лежить в межах 4,5 – 5. Додавання в поживне середовище цукру (понад 15 %) або солі (понад 1 – 1,5 %) негативно впливає на життєдіяльність дріжджів. Гнітюче діє і етиловий спирт у концентрації 2 – 5 % об. При вмісті 12 – 14 % спирту бродіння в більшості випадків припиняється. З підвищенням температури пригнічуюча дія спирту зростає [36].
5.3. Таксономічний статус
У 2006 р. опубліковано філогенетичну класифікацію аскоміцетних дріжджів [35]. Згідно з нею дріжджі Saccharomyces cerevisiae займають наступне положення:
Підвідділ
Клас
Порядок
Родина
Рід
Вид
Saccharomycotina
Saccharomycetes
Saccharomycetale
Saccharomycetaceae
Saccharomyces
Saccharomyces cerevisia
5.4. Схема біотрансформації ростового субстрату в ергостерин
В раніше обраному складі поживного середовища (розділ 4: 4.2. Обґрунтування вибору складу поживного середовища) для вирощування біологічного агента Saccharomyces cerevisiae головним ростовим субстратом була глюкоза [30].
Глюкоза найпоширеніша органічна речовина на Землі. Вуглеводи є найуживанішим субстратом для культивування промислово важливих мікроорганізмів, які є об’єктами біотехнології. Відомо чотири шляхи катаболізму глюкози, які функціонують у мікроорганізмів [35].
Для дріжджів Saccharomyces cerevisiae основним шляхом катаболізму глюкози є фруктозо-1,6-дифосфатний шлях (гліколіз, шлях Ембдена – Мейєргофа – Парнаса) [40].
Уперше гліколіз був відкритий у м’язових тканинах. При функціонуванні гліколізу, глюкоза перетворюється на піруват і генерується невелика кількість АТФ (енергії). Це центральний шлях, який виробляє важливі метаболічні попередники: шестивуглецеві сполуки глюкозо-6-фосфат та фруктозо-6-фосфат і тривуглецеві сполуки гліцеральдегід-3-фосфат, 3-фосфогліцерат, фосфоенолпіруват і піруват. Також важливим метаболічним попередником є Ацетил-КоА, який утворюється шляхом окисненого декарбоксилювання пірувату [40].
У результаті катаболізму глюкози утворюється один з найважливіших метаболітів – піруват, який є попередником багатьох продуктів. Дріжджі S. cerevisiae окиснюють піруват до ацетил-коферменту А (ацетил-КоА) [35, 40].
Синтез стеринів здійснюється з ацетил-КоА як вихідної сполуки. В результаті послідовних реакцій перетворення цієї сполуки утворюється фарнезілпірофосфат, дві молекули якого з’єднуються за місцем приєднання пірофосфатних груп з відщепленням останніх. В результаті реакції синтезується ненасичений вуглеводень – сквален. Через сквален-2,3-оксид за шляхом перетворень ланостерину виникає природній стерин – ергостерин (рис. 5.4) [20, 40].
Рис. 5.4. Схема біотрансформації ростового субстрату в ергостерин
Г
1 люкоза
люкоза
Г
2
Ф
3

Ф
4
4
5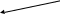 руктозо-1,6-дифосфат
руктозо-1,6-дифосфат
6 Діоксиацетонфосфат
Гліцеральдегід-3-фосфат
Діоксиацетонфосфат
Гліцеральдегід-3-фосфат
1
7
3
8
2
9*
Ф
10
П
11
2
11
А
12
А
16
15
14
13
І
19
18
17
20
19
П
20
С
21
С
22
Л
23
4
24
1
25
4
26
3
27
4 -Метилзимостерин
З
28
Ф
29
Е
30
