
- •1О. Кинематика поступательного движения.
- •2О. Кинематика вращательного движения.
- •3О. Динамика частиц. Закон ньютона.
- •4О. Неинерциальные системы отсчета (нсо). Силы инерции.
- •5О. Основное ур-ние динамики вращательного движения тв. Тела.
- •7О. Закон сохранения импульса.
- •8О. Работа.Мощность.Кинетическая энергия системы.
- •9О. Потенциальная энергия системы.
- •10. Закон сохранения энергии в механике
- •11О. Закон сохранения момента импульса.
- •12О. Движение тела переменной массы.
- •13О. Кинематика гарманических колебаний
- •14О. Гармонический осциллятор.
- •15О. Примеры гармонических осцилляторов.
- •16. Сложение гармонических колебаний одного направления и частоты.
- •17. Сложение взаимно перпендикулярных гармонических колебаний.
- •18. Затухающие колебания.
- •19.Вынужденные колебания. Резонанс.
- •20.Упругие волны в средах.
- •21О.Бегущие волны. Фазовая скорость. Длина волны. Волновое число.
- •22. Одномерное волновое ур-е. Энергия волны.
- •23. Распространение волн в средах с дисперсией. Групповая скорость, ее связь с фазовой скоростью.
- •24. Стоячие волны
- •25. Элементы акустики.
- •26.Модуль Юнга. Скорость звука.
- •28. Постулаты сто. Преобразование
- •29. Средства преобразования Лоренца.
- •30. Релятивистский закон сложения скоростей.
- •31. Интервал между событиями и его инвариантность в преобразовании Лоренца
- •32. Релятивистская динамика, кинетическая энергия сто.
- •33. Связь массы, энергии, импульса в сто
- •34О. Эффект Доплера
- •35О. Принцип эквиваленности.Понятие о ото
- •36О. Равновесие и течение жидкости и газа
- •37О. Уравнение неразрывности струи. Уравнение Бернулли
- •38. Уравнение Эйлера. Движение идеальной жидкости.
- •39. Течение вязкой жидкости. Формула Стокса.
- •40. Течение вязкой жидкости в трубах. Формула Пуазейля.
- •41. Динамический и статистический закономерности в физике.
- •42. Уравнение состояния идеального газа.
- •43. Основное уравнение молекулярно-кинетической теории газов (мкт).
- •44. Молекулярно-кинетический смысл абсолютной температуры.
- •45. Распределение Максвелла.
- •46. Параметрическая формула распределения Больцмана.
- •47. Распределение Гиббса.
- •48. Первое начало термодинамики.
- •49. Теплоемкость многоатомных газов.
- •50. Применение I начала термодинамики к изопроцессам(термодинамическим процессам).
- •51. Адиабатический процесс.
- •52. Политропный процесс
- •53. Теплоемкость и работа газа в политропном процессе
- •54. Обратимые и необратимые процессы, круговой процесс, тепловые двигатели, холодильные машины.
- •55. Цикл Карно. Максимальный кпд тепловой машины.
- •56. Технические циклы.
- •57. Второе начало термодинамики (6 формулировок).
- •58. Энтропия
- •59.Принцип возрастания энтропии
- •60. Определение энтропии неравновесной системы через статистический вес состояния. III начало термодинамики.
- •61. Метод термодинамических потенциалов (характеристических функций).
- •62. Явления переноса. Средняя длина свободного пробега молекул.
- •63. Коэффициент диффузии.
- •64. Теплопроводность. Коэффициент теплопроводности.
- •65. Уравнение теплопроводности.
- •66. Вязкость. Коэффициент вязкости.
- •67. Фазовые равновесия и превращения. Фазы и фазовые превращения.
- •68. Уравнение Клайперона - Клаузиса.
- •69. Реальные газы. Уравнение Ван – дер - Вальса .
- •70. Изотермы Ван-дер-Ваальса. Критич. Состояние. Внутр. Энергия реального газа.
- •71. Твёрдые тела.Теплоёмкость кристалла
- •72. Жидкости.Поверхн. Натяж. Жидк.
- •73. Смачивание и капиллярные явления
- •74. Принцип динамич. Отопления
- •75. Элементы физики полимеров
- •1О. Кинематика поступательного движения.
71. Твёрдые тела.Теплоёмкость кристалла
Тв.
тела отлич. от газообр. и жидкю постоянством
формы, V. Они делятся на кристаллич. и
аморфные.Большее число тв. тел кристалл-кие.
Для кристаллов харак-но наличие
кристаллич. решётки. Кристалл как правило
проявл. анизотропные физ. св-ва (разные
по разным направл.) Аморфные тела –
переохлажд. жидкости(стекло, смола,
битум). Они проявл. изотропные св-ва.
Вычислим теплоёмк. кристалла.Т.к. V тв.
тел маломеняется, то теплоёмк Cp
и CV
примерно
одинаковы и можно говорить просто о
теплоёмкости С. Внутр. энергия крист.
решётки тв. тела сост. из кинетич. и
потенц. энергии атомов и ионов в узлах
этой решётки. При этом на кажд. степ.
свободы приход-ся
kT
в виде кинетич. энергии и
kT
в виде потенц. энергии.
kT+
kT=kT.
Т.к. атом имеет 3 степ. свободы, то энергия
атома будет 3kT.
Так как 1 моль содерж NА
атомов, то внутр. энергия U= NА 3kT=3RT.
Теплоёмкость
С=
=
3kT=3RT.
Теплоёмкость
С=
= +
(
=0);
C=3R
≈25
+
(
=0);
C=3R
≈25

З-н Дюлонга и Пти (1815). «Молярн. теплоёмк. кристаллич. атомарных тел одинакова и равна 3R».
П ри
низк. темпер. наблюд. отклонение от з-на
Дюл. и Пти, при этом происх. постеп.
«вымерзание» колебательн. степеней
свободы.При низк. темп. теплоёмк. мен-ся
по з-ну С= const∙
ри
низк. темпер. наблюд. отклонение от з-на
Дюл. и Пти, при этом происх. постеп.
«вымерзание» колебательн. степеней
свободы.При низк. темп. теплоёмк. мен-ся
по з-ну С= const∙ (з-н
П.Дебая)
(з-н
П.Дебая)
На графике з-н Дебая им. вид:
72. Жидкости.Поверхн. Натяж. Жидк.
Различают. тв., жидк. и газообр. состоян. вещ-ва.Они связаны с постоянством формы и V тела. Ф.Каменецкий считал, что плазма–4-ое состоян. вещ-ва.5-ое сост. – жидкокристаллическое(ЖК) пример–жидкие кристаллы. Жидк. состоян. вещ-ва заним. промеж. состоян. между газообр. и кристалл-ким. Для жидк. как и для тв. тел хар-но налич. определ. объёма. Но жидк. подобно газу заним. форму сосуда, в кот. она наход-ся. Жидк. слабосжим. Молекулярн. давление для них доходит до р*=20000атм. В расположении частей жидк-ти наблюд. ближн. порядок, т.е. по отнош. к люб. частице жидк-ти расположение соседн. частиц явл. упорядоченным, а далее упорядочен-ть быстро убыв. В жидк. из-за отсутсвия дальнего порядка обычно не проявл. анизотропные св-ва, однако это не относ-ся к жидк.кристаллам и анизотропн. жидк-тям. Силы взаимод. между молекулами жидк. играют большую роль, чем в газах. В поверхн. слое жидк-ти обнаружив-ся нескомпенсиров. межмолекулярн сил.Частицы жидк. в этом случае испыт. силу притяж. со стор. друг частиц, направл. внутрь жидк-ти.
П
 ереход
молекулы из глубины жидк-ти в поверхн.
слой связан с работой против действ-щих
в поверх. слое сил. На эту работу молекула
тратит часть своей кинетич. энерг.,но
зато приобрет. потенц. энергию. Из-за
наличия поверх-ной энергии жидк-ть ведёт
себя,как если бы она заключалась в
упругую растянутую плёнку, кот. стрем-ся
сжаться. Рассм. проволочн. каркас,
затянутый мыльной жидкостью (мыльный
пузырь).
ереход
молекулы из глубины жидк-ти в поверхн.
слой связан с работой против действ-щих
в поверх. слое сил. На эту работу молекула
тратит часть своей кинетич. энерг.,но
зато приобрет. потенц. энергию. Из-за
наличия поверх-ной энергии жидк-ть ведёт
себя,как если бы она заключалась в
упругую растянутую плёнку, кот. стрем-ся
сжаться. Рассм. проволочн. каркас,
затянутый мыльной жидкостью (мыльный
пузырь).
Чтобы
удержать жидк-ть в равновесии надо
прилож. силу
к линии свободн. границы
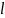 .Эта
сила лежит в пл-ти плёнки и направл. по
нормали к линии границы плёнки. Опыт
показыв.,что
поверхн-го натяж. пропорц
.
.Эта
сила лежит в пл-ти плёнки и направл. по
нормали к линии границы плёнки. Опыт
показыв.,что
поверхн-го натяж. пропорц
.
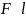 ; F=α
(α-коэффиц. поверхн. натяж. зависит от
рода жидк-ти и темпер.)
; F=α
(α-коэффиц. поверхн. натяж. зависит от
рода жидк-ти и темпер.)
1.
α=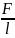 .
Коэффиц. поверхн. натяж. α численно равен
силе, прилож. к единице длины края
поверх-ной плёнки жидк-ти.
=1;
=F;
.
Коэффиц. поверхн. натяж. α численно равен
силе, прилож. к единице длины края
поверх-ной плёнки жидк-ти.
=1;
=F;
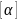 =
=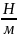 ;
;
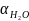 =0,073
;
t=20°С;
=0,073
;
t=20°С;
 =0,49
.
Найдём работу, кот. надо соверш., чтобы
увелич. S поверхн-ной плёнки на ΔS
=0,49
.
Найдём работу, кот. надо соверш., чтобы
увелич. S поверхн-ной плёнки на ΔS
Δ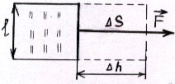 А=ΔhF=Δhα
=αΔS;
α=
А=ΔhF=Δhα
=αΔS;
α=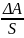 .
Работа ΔА идёт на увелич. внутр. энергии
плёнки (своб. энергии плёнки) α=
.
Работа ΔА идёт на увелич. внутр. энергии
плёнки (своб. энергии плёнки) α=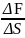 (ΔS=1)
(ΔS=1)
2.
Коэффиц. поверхн. натяж. численно равен
изменению своб. энергии поверхн-ной
плёнки при увелич. её площади на 1.
=
С ростом темпер. α уменьш:1)на языке сил (с ростом темпер. увеличив V жидк-ти и соотв. увеличив. расстоян. между молекулами жидк и значит уменьш. α); 2)на языке энергий(если темпер. растёт, то молекула увелич. свою кинетич. энергию. Молекуле легче проникн. в поверхн-ный слой и роль потенц. энергии уменьш.) Поверх-ный слой жидк-ти аналогичен упругой плёнке по поведению,но есть различия.Натяжение обычной упругой плёнки прямопропорц. деформации плёнки и =0 при некот. конечной площади упругой плёнки. Поверх-ное натяж. жидк. не завис. от размера свободн. пов-ти и стрем-ся сократить его до 0.Это обусловл. тем, что при изотерм. сжат. и расшир. жидких плёнок измен. число молекул, содерж. в плёнке, а средн.расстоян. между молекулами не мен-ся, а потому не меняется и сила поверх-ного сцепл., стремящ-ся сжать плёнку.
