
- •1О. Кинематика поступательного движения.
- •2О. Кинематика вращательного движения.
- •3О. Динамика частиц. Закон ньютона.
- •4О. Неинерциальные системы отсчета (нсо). Силы инерции.
- •5О. Основное ур-ние динамики вращательного движения тв. Тела.
- •7О. Закон сохранения импульса.
- •8О. Работа.Мощность.Кинетическая энергия системы.
- •9О. Потенциальная энергия системы.
- •10. Закон сохранения энергии в механике
- •11О. Закон сохранения момента импульса.
- •12О. Движение тела переменной массы.
- •13О. Кинематика гарманических колебаний
- •14О. Гармонический осциллятор.
- •15О. Примеры гармонических осцилляторов.
- •16. Сложение гармонических колебаний одного направления и частоты.
- •17. Сложение взаимно перпендикулярных гармонических колебаний.
- •18. Затухающие колебания.
- •19.Вынужденные колебания. Резонанс.
- •20.Упругие волны в средах.
- •21О.Бегущие волны. Фазовая скорость. Длина волны. Волновое число.
- •22. Одномерное волновое ур-е. Энергия волны.
- •23. Распространение волн в средах с дисперсией. Групповая скорость, ее связь с фазовой скоростью.
- •24. Стоячие волны
- •25. Элементы акустики.
- •26.Модуль Юнга. Скорость звука.
- •28. Постулаты сто. Преобразование
- •29. Средства преобразования Лоренца.
- •30. Релятивистский закон сложения скоростей.
- •31. Интервал между событиями и его инвариантность в преобразовании Лоренца
- •32. Релятивистская динамика, кинетическая энергия сто.
- •33. Связь массы, энергии, импульса в сто
- •34О. Эффект Доплера
- •35О. Принцип эквиваленности.Понятие о ото
- •36О. Равновесие и течение жидкости и газа
- •37О. Уравнение неразрывности струи. Уравнение Бернулли
- •38. Уравнение Эйлера. Движение идеальной жидкости.
- •39. Течение вязкой жидкости. Формула Стокса.
- •40. Течение вязкой жидкости в трубах. Формула Пуазейля.
- •41. Динамический и статистический закономерности в физике.
- •42. Уравнение состояния идеального газа.
- •43. Основное уравнение молекулярно-кинетической теории газов (мкт).
- •44. Молекулярно-кинетический смысл абсолютной температуры.
- •45. Распределение Максвелла.
- •46. Параметрическая формула распределения Больцмана.
- •47. Распределение Гиббса.
- •48. Первое начало термодинамики.
- •49. Теплоемкость многоатомных газов.
- •50. Применение I начала термодинамики к изопроцессам(термодинамическим процессам).
- •51. Адиабатический процесс.
- •52. Политропный процесс
- •53. Теплоемкость и работа газа в политропном процессе
- •54. Обратимые и необратимые процессы, круговой процесс, тепловые двигатели, холодильные машины.
- •55. Цикл Карно. Максимальный кпд тепловой машины.
- •56. Технические циклы.
- •57. Второе начало термодинамики (6 формулировок).
- •58. Энтропия
- •59.Принцип возрастания энтропии
- •60. Определение энтропии неравновесной системы через статистический вес состояния. III начало термодинамики.
- •61. Метод термодинамических потенциалов (характеристических функций).
- •62. Явления переноса. Средняя длина свободного пробега молекул.
- •63. Коэффициент диффузии.
- •64. Теплопроводность. Коэффициент теплопроводности.
- •65. Уравнение теплопроводности.
- •66. Вязкость. Коэффициент вязкости.
- •67. Фазовые равновесия и превращения. Фазы и фазовые превращения.
- •68. Уравнение Клайперона - Клаузиса.
- •69. Реальные газы. Уравнение Ван – дер - Вальса .
- •70. Изотермы Ван-дер-Ваальса. Критич. Состояние. Внутр. Энергия реального газа.
- •71. Твёрдые тела.Теплоёмкость кристалла
- •72. Жидкости.Поверхн. Натяж. Жидк.
- •73. Смачивание и капиллярные явления
- •74. Принцип динамич. Отопления
- •75. Элементы физики полимеров
- •1О. Кинематика поступательного движения.
64. Теплопроводность. Коэффициент теплопроводности.
Теплопроводность в газе – направленный перенос кинетической энергии молекул за счет хаотичного теплового движения молекул и их сталкивании. При наличии неоднородной температуры, в результате чего происходит выравнивание температур в газе до достижения полного равновесия.
Рассмотрим одномерный случай:
Рассмотрим
одноатомный газ и пусть градиент
температуры равен

2 предположения, компенсирующие друг друга:
1) будем считать, что в соседних слоях средняя энергия различна, а средняя скорость – одинаковая.
2) концентрация молекул в соседних слоях одинаковая n

Тепловой поток через площадь за время равен:

Тогда тепловой поток проходящий через единицу площади за единицу времени:

Тепловой поток пропорционален градиенту температуры. Знак ‘‘минус’’ – q направлено в сторону убывания температуры. Коэффициент теплопроводности численно равен количеству тепла, проходящего через единицу площади соприкасающихся слоев за единицу времени, при градиенте температуры равном (-1).
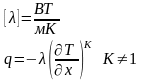
65. Уравнение теплопроводности.
Уравнение теплопроводности описывает процесс переноса тепла в одномерном случае.

Ц илиндр
АВ расположен вдоль оси х, плотность
газа
илиндр
АВ расположен вдоль оси х, плотность
газа
 длина
поперечного сечения
длина
поперечного сечения
Тепло,
поступающее в цилиндр за время dt
через основание А равно:

Тепло, выходящее из цилиндра

Тепло, поступающее в цилиндр АВ

С
другой стороны это тепло можно представить
виде :

dm-
масса газа :
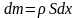
с-удельная
теплоемкость :

Приравниваем

В двумерном

К уравнению теплопроводности необходимо задать граничные и начальные условия, тогда приходим к краевой задачи Коши:

66. Вязкость. Коэффициент вязкости.
Я вл.
вязкости в газе - это направленный
перенос импульса упорядоченного движения
молекул за счет их хаотичного движ при
наличии градиента скорости упорядочн
движ
вл.
вязкости в газе - это направленный
перенос импульса упорядоченного движения
молекул за счет их хаотичного движ при
наличии градиента скорости упорядочн
движ


Импульс упорядочен. движ равен переносимый через ∆S:

По
2 закону Ньютона: изменение импульса
слоя = импульсу силы трения, действ за
 в направлении скор
в направлении скор
 параллельной
параллельной

т.е.
Fтр
=
fтр
=
 =
=
Закон Внутр трения(вязкости) Ньютона:
fтр=
- ; η – к-т динамической вяз-ти
; η – к-т динамической вяз-ти


Сила
внутр тр при макроскопич движении газа
пропорциональна градиенту скор газа
упорядочн движ. Возникает за счёт
переноса импульса. Коэффициент вязкости
численно равен силе внутр тр, на ед S
при градиенте скор = -1,

Киниматич коэф вязкости есть динамич дел на
 , [м2
/с]
, [м2
/с]
Не Ньтоновская вязкость жидкости:

67. Фазовые равновесия и превращения. Фазы и фазовые превращения.
Ф азой
наз. Макроскопическое физически
однородная часть вещества, отделенная
границами от остальн части сист. В сист
может быть несколько ТВ и жидк фаз, но
газообразн только 1. Различн фазы явл
агрегатн сост вещва (ж, т, г). Фаза - более
широкое понятие, чем агрегатное сост
вещва могут сущ различн фазы одного
агр сост. Различн фазы одного и того же
вещва могутнаходиться в тепловом и
механич равновесии. При тепловом
равновесии темпер фаз одинакова, при
механич равновес существование 2 фаз
возможно при опр знач t
и p.
Переход вещва из 1 фазы в 2 – это фазовый
переход. Различают фазовый переход 1 и
2 –го рода. Примеры: сублимация, испарение,
кристаллизация, плавление.
азой
наз. Макроскопическое физически
однородная часть вещества, отделенная
границами от остальн части сист. В сист
может быть несколько ТВ и жидк фаз, но
газообразн только 1. Различн фазы явл
агрегатн сост вещва (ж, т, г). Фаза - более
широкое понятие, чем агрегатное сост
вещва могут сущ различн фазы одного
агр сост. Различн фазы одного и того же
вещва могутнаходиться в тепловом и
механич равновесии. При тепловом
равновесии темпер фаз одинакова, при
механич равновес существование 2 фаз
возможно при опр знач t
и p.
Переход вещва из 1 фазы в 2 – это фазовый
переход. Различают фазовый переход 1 и
2 –го рода. Примеры: сублимация, испарение,
кристаллизация, плавление.
Р авновесие
2 фаз возможно только вдоль определённой
линии: p
= p(t).
Равновесие 3 фаз – в одной точке (тройной):
авновесие
2 фаз возможно только вдоль определённой
линии: p
= p(t).
Равновесие 3 фаз – в одной точке (тройной):
tтр = 0,01оС
pТР = 4,62 мм рт ст
возможно существование нескольких тройных точек.
Фазовый переход 2-го рода не связаны с теплотой фаз перехода, они связаны с модификацией кристалл решетки при этом могут меняться скачком такие характеристики: теплоемкость, коэф тепл расшир
Фазовый переход 2-го рода, пример:
Переход некоторметаловпри сверхнизких темпер в сверх проводящ расстояния
Переход ферромагнетика железа в обычн паростаметик со слабым магн свовами.
Переход Гелий 1 в Гелий 2 (где энта=0)
