- •1О. Кинематика поступательного движения.
- •2О. Кинематика вращательного движения.
- •3О. Динамика частиц. Закон ньютона.
- •4О. Неинерциальные системы отсчета (нсо). Силы инерции.
- •5О. Основное ур-ние динамики вращательного движения тв. Тела.
- •7О. Закон сохранения импульса.
- •8О. Работа.Мощность.Кинетическая энергия системы.
- •9О. Потенциальная энергия системы.
- •10. Закон сохранения энергии в механике
- •11О. Закон сохранения момента импульса.
- •12О. Движение тела переменной массы.
- •13О. Кинематика гарманических колебаний
- •14О. Гармонический осциллятор.
- •15О. Примеры гармонических осцилляторов.
- •16. Сложение гармонических колебаний одного направления и частоты.
- •17. Сложение взаимно перпендикулярных гармонических колебаний.
- •18. Затухающие колебания.
- •19.Вынужденные колебания. Резонанс.
- •20.Упругие волны в средах.
- •21О.Бегущие волны. Фазовая скорость. Длина волны. Волновое число.
- •22. Одномерное волновое ур-е. Энергия волны.
- •23. Распространение волн в средах с дисперсией. Групповая скорость, ее связь с фазовой скоростью.
- •24. Стоячие волны
- •25. Элементы акустики.
- •26.Модуль Юнга. Скорость звука.
- •28. Постулаты сто. Преобразование
- •29. Средства преобразования Лоренца.
- •30. Релятивистский закон сложения скоростей.
- •31. Интервал между событиями и его инвариантность в преобразовании Лоренца
- •32. Релятивистская динамика, кинетическая энергия сто.
- •33. Связь массы, энергии, импульса в сто
- •34О. Эффект Доплера
- •35О. Принцип эквиваленности.Понятие о ото
- •36О. Равновесие и течение жидкости и газа
- •37О. Уравнение неразрывности струи. Уравнение Бернулли
- •38. Уравнение Эйлера. Движение идеальной жидкости.
- •39. Течение вязкой жидкости. Формула Стокса.
- •40. Течение вязкой жидкости в трубах. Формула Пуазейля.
- •41. Динамический и статистический закономерности в физике.
- •42. Уравнение состояния идеального газа.
- •43. Основное уравнение молекулярно-кинетической теории газов (мкт).
- •44. Молекулярно-кинетический смысл абсолютной температуры.
- •45. Распределение Максвелла.
- •46. Параметрическая формула распределения Больцмана.
- •47. Распределение Гиббса.
- •48. Первое начало термодинамики.
- •49. Теплоемкость многоатомных газов.
- •50. Применение I начала термодинамики к изопроцессам(термодинамическим процессам).
- •51. Адиабатический процесс.
- •52. Политропный процесс
- •53. Теплоемкость и работа газа в политропном процессе
- •54. Обратимые и необратимые процессы, круговой процесс, тепловые двигатели, холодильные машины.
- •55. Цикл Карно. Максимальный кпд тепловой машины.
- •56. Технические циклы.
- •57. Второе начало термодинамики (6 формулировок).
- •58. Энтропия
- •59.Принцип возрастания энтропии
- •60. Определение энтропии неравновесной системы через статистический вес состояния. III начало термодинамики.
- •61. Метод термодинамических потенциалов (характеристических функций).
- •62. Явления переноса. Средняя длина свободного пробега молекул.
- •63. Коэффициент диффузии.
- •64. Теплопроводность. Коэффициент теплопроводности.
- •65. Уравнение теплопроводности.
- •66. Вязкость. Коэффициент вязкости.
- •67. Фазовые равновесия и превращения. Фазы и фазовые превращения.
- •68. Уравнение Клайперона - Клаузиса.
- •69. Реальные газы. Уравнение Ван – дер - Вальса .
- •70. Изотермы Ван-дер-Ваальса. Критич. Состояние. Внутр. Энергия реального газа.
- •71. Твёрдые тела.Теплоёмкость кристалла
- •72. Жидкости.Поверхн. Натяж. Жидк.
- •73. Смачивание и капиллярные явления
- •74. Принцип динамич. Отопления
- •75. Элементы физики полимеров
- •1О. Кинематика поступательного движения.
49. Теплоемкость многоатомных газов.
Ч ислом
степеней свободы i- назыв-ся число
независимых параметров координат,
характеризующих состояние системы.
Молекулу одноатомного газа можно
рассматривать как материальную точку,
положение которой хар-ся тремя
координатами: одноатомный газ (He) : i=3
(x,y.z). Молекулы двухатомного газа(
ислом
степеней свободы i- назыв-ся число
независимых параметров координат,
характеризующих состояние системы.
Молекулу одноатомного газа можно
рассматривать как материальную точку,
положение которой хар-ся тремя
координатами: одноатомный газ (He) : i=3
(x,y.z). Молекулы двухатомного газа(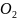 )
можнр рассматрив. как систему 2-ух
материальных точек с жесткой связью.
)
можнр рассматрив. как систему 2-ух
материальных точек с жесткой связью.
Трехатомный
газ (C
i = 3+3+3-1-1-1=6
Е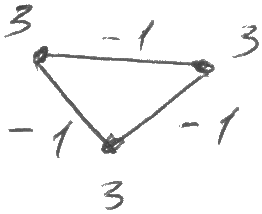 сли
связи молекул нежесткие, то необходимо
учитывать и колебательн. степени свободы.
Число степеней свободы i равно сумме
чисел степеней свободы поступательного
движения, вращательн. Движения и
удвоенного числа степеней колебательного
движения:
сли
связи молекул нежесткие, то необходимо
учитывать и колебательн. степени свободы.
Число степеней свободы i равно сумме
чисел степеней свободы поступательного
движения, вращательн. Движения и
удвоенного числа степеней колебательного
движения:
i=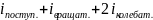
Средняя кинетич. энергия идеального одноатомного газа с числом степеней свободы i=3 равна:

Т.к.
все степени свободы равноправны, то на
одну степень свободы приходится
энергия= .
Тогда приходим к закону о равном
распределении энергии по степеням
свободы. Для системы в термодин. Равновесии
на каждую степень свободы приходится
Е=
Тогда для молекулы многоатомного газа
с числом степени свободы i: Е=
.
Тогда приходим к закону о равном
распределении энергии по степеням
свободы. Для системы в термодин. Равновесии
на каждую степень свободы приходится
Е=
Тогда для молекулы многоатомного газа
с числом степени свободы i: Е=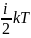
Найдем внутрен. энергию одного моля идеалього газа:
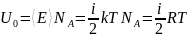
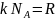 ;
;
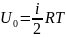 ; U=
; U= RT
RT
Теплоемкость тела - кол-во теплоты, которую надо сообщить телу, чтобы нагреть его на 1 К (кельвин)

Молярная
теплоемкость-кол-во теплоты, которую
надо сообщить или отнять от одного моля
в-ва, чтобы нагреть или охладить его на
1К. )
 ; [C]=
; [C]=
Удельная
теплоемкость- кол-во теплоты, которую
надо сообщить 1кг в-ва, чтобы нагреть
его на 1К.
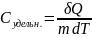 [
[
δQ= ;
Q=
;
Q=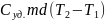
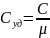
Теплоемкость
в-ва зависит от вида протекающего
процесса. В газе различают теплоемкость
при постоянном объеме и постоянном
давлении. (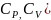
δQ=dU+pdV;
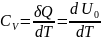
ν=1,
V=const, dV=0
; d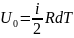 ;
;
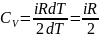 ;
;
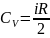
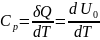 +
+
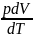 ;
pV=RT
;
pV=RT
p=const; pdV=RdT
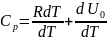 ;
;

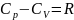 -
ф-ла
Майера
-
ф-ла
Майера

 - показатель адиабаты.
- показатель адиабаты.
Мы рассмотрели классическую теорию теплоемкости: теплоемкости не зависят от температуры. Однако при низких температ. важную роль начинают играть квантовые эффекты (происходит замораживание вращат. и колебат. степней свободы и появляется зависимость теплоемкости от температуры).
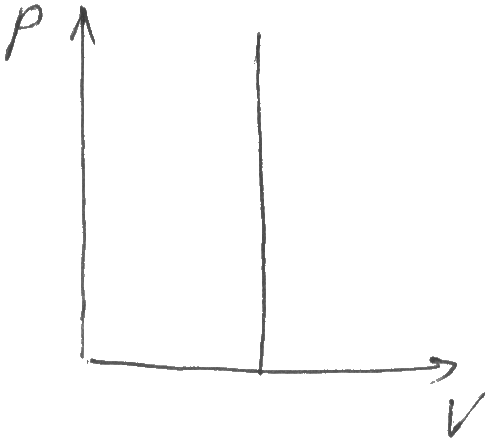
50. Применение I начала термодинамики к изопроцессам(термодинамическим процессам).
Изопоцесс – термодинамич. проц.,при кот. один из параметров остается постоянным.
T=const – изотермическ., p=const – изобарн.,
V = const – изохорн.,
δQ = const – изэнтропический
1) T = const
δQ
= dU+δA
; dU =
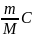 VdT
= 0
VdT
= 0
δQ= δA все тепло,сообщенное сист. в изотермическом проц. идет на работу
δ A=pdV
A=pdV
p= ; δA=
; δA=
Проинтегрируем обе части ур-я от сост. V1 к V2
A12=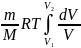 ; A12=
; A12=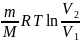
2) p=const
δQ=dU+ pdV тепло сообщ. сист. в изобарн. проц. идет на измен. внутрен. энергии и на работу сист.
Работа в изобарном проц.:
δA=pdV
A12=p ; A12=p(V2-V1)
; A12=p∆V
; A12=p(V2-V1)
; A12=p∆V
d||
pV= возьмем дифференциал
возьмем дифференциал
pdV=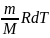 ; δA=
; δA=
Проинтегрируем:
A
=
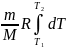 ; A =
; A =
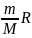 (T2-T1)
; A =
∆T
(T2-T1)
; A =
∆T
ν
=
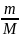 = 1моль
= 1моль
R
=
 физический смысл: универсальная газовая
постоян. R
численно равна работе 1 моля идеального
газа при изобарном нагревании его на 1
К.
физический смысл: универсальная газовая
постоян. R
численно равна работе 1 моля идеального
газа при изобарном нагревании его на 1
К.
3) V=const
δQ=dU
δA=pdV=0 тепло сообщ. сист. в изохорн. проц. идет на увелич. внутр. энерг. сист.