
- •1О. Кинематика поступательного движения.
- •2О. Кинематика вращательного движения.
- •3О. Динамика частиц. Закон ньютона.
- •4О. Неинерциальные системы отсчета (нсо). Силы инерции.
- •5О. Основное ур-ние динамики вращательного движения тв. Тела.
- •7О. Закон сохранения импульса.
- •8О. Работа.Мощность.Кинетическая энергия системы.
- •9О. Потенциальная энергия системы.
- •10. Закон сохранения энергии в механике
- •11О. Закон сохранения момента импульса.
- •12О. Движение тела переменной массы.
- •13О. Кинематика гарманических колебаний
- •14О. Гармонический осциллятор.
- •15О. Примеры гармонических осцилляторов.
- •16. Сложение гармонических колебаний одного направления и частоты.
- •17. Сложение взаимно перпендикулярных гармонических колебаний.
- •18. Затухающие колебания.
- •19.Вынужденные колебания. Резонанс.
- •20.Упругие волны в средах.
- •21О.Бегущие волны. Фазовая скорость. Длина волны. Волновое число.
- •22. Одномерное волновое ур-е. Энергия волны.
- •23. Распространение волн в средах с дисперсией. Групповая скорость, ее связь с фазовой скоростью.
- •24. Стоячие волны
- •25. Элементы акустики.
- •26.Модуль Юнга. Скорость звука.
- •28. Постулаты сто. Преобразование
- •29. Средства преобразования Лоренца.
- •30. Релятивистский закон сложения скоростей.
- •31. Интервал между событиями и его инвариантность в преобразовании Лоренца
- •32. Релятивистская динамика, кинетическая энергия сто.
- •33. Связь массы, энергии, импульса в сто
- •34О. Эффект Доплера
- •35О. Принцип эквиваленности.Понятие о ото
- •36О. Равновесие и течение жидкости и газа
- •37О. Уравнение неразрывности струи. Уравнение Бернулли
- •38. Уравнение Эйлера. Движение идеальной жидкости.
- •39. Течение вязкой жидкости. Формула Стокса.
- •40. Течение вязкой жидкости в трубах. Формула Пуазейля.
- •41. Динамический и статистический закономерности в физике.
- •42. Уравнение состояния идеального газа.
- •43. Основное уравнение молекулярно-кинетической теории газов (мкт).
- •44. Молекулярно-кинетический смысл абсолютной температуры.
- •45. Распределение Максвелла.
- •46. Параметрическая формула распределения Больцмана.
- •47. Распределение Гиббса.
- •48. Первое начало термодинамики.
- •49. Теплоемкость многоатомных газов.
- •50. Применение I начала термодинамики к изопроцессам(термодинамическим процессам).
- •51. Адиабатический процесс.
- •52. Политропный процесс
- •53. Теплоемкость и работа газа в политропном процессе
- •54. Обратимые и необратимые процессы, круговой процесс, тепловые двигатели, холодильные машины.
- •55. Цикл Карно. Максимальный кпд тепловой машины.
- •56. Технические циклы.
- •57. Второе начало термодинамики (6 формулировок).
- •58. Энтропия
- •59.Принцип возрастания энтропии
- •60. Определение энтропии неравновесной системы через статистический вес состояния. III начало термодинамики.
- •61. Метод термодинамических потенциалов (характеристических функций).
- •62. Явления переноса. Средняя длина свободного пробега молекул.
- •63. Коэффициент диффузии.
- •64. Теплопроводность. Коэффициент теплопроводности.
- •65. Уравнение теплопроводности.
- •66. Вязкость. Коэффициент вязкости.
- •67. Фазовые равновесия и превращения. Фазы и фазовые превращения.
- •68. Уравнение Клайперона - Клаузиса.
- •69. Реальные газы. Уравнение Ван – дер - Вальса .
- •70. Изотермы Ван-дер-Ваальса. Критич. Состояние. Внутр. Энергия реального газа.
- •71. Твёрдые тела.Теплоёмкость кристалла
- •72. Жидкости.Поверхн. Натяж. Жидк.
- •73. Смачивание и капиллярные явления
- •74. Принцип динамич. Отопления
- •75. Элементы физики полимеров
- •1О. Кинематика поступательного движения.
44. Молекулярно-кинетический смысл абсолютной температуры.
Сравним уравнение К-М с основным уравнением МКТ:
PV= νRT ν=1 ν=m/M
P=(2/3)n<E> n=Na/Vo P=(2/3) (Na/Vo) <E>
P=RT/Vo, где Vo – молярный объем
<E>=(3/2)(R/Na)T
Постоянная Больцмана называется универсальная газовая постоянная, отнесенная к 1 молекуле.
k=R/Na=1,38 10-23 Дж/К
<E>=3/2kТ
Абсол темпер ид газа пропорциональна средней кинетической энергии поступательного движения молекул газа: P = nkT.
45. Распределение Максвелла.
Из опыта следует, что газ, заключенный в изолированный сосуд, в отсутствии внешних воздействий (полей) со временем прихода в равновесное стационарное состояние. Распределение максвелла задает распределение молекул по скоростям. Механизм установления такого распределения – это бесчисленные столкновения молекул газа между собой. В силу хаотического движения молекул все направления скорости молекул равномерны, т.е по всем направлениям в среднем движется одинаковое число молекул, тогда распределение скорости одинаково.
Получим вид функций распределенных молекул для модуля скоростей. Выражение f(v)dv дает вероятность того, что скорость наугад выбранной молекулы лежит в пределах (v;v+dv). Выражение f(v)dv дает долю молекул dN(v)dv/N от их общего числа, скорости кот-ых заключены в пределы (v;v+dv)
Пусть φ(vx)dvx есть вероятность того, что х-овая компонента скорости молекул лежит в пределах (vx; vx+dvx). Эту вероятность можно представить f(v)dvxdvydvz где f(v) = φ(vx)* *φ(vy) *φ(vz) - Т.к отриц и положительные компоненты скоростей равноправны, то φ(vx)=φ(-vx) тогда функция φ зависит только от модуля скорости или от квадрата скорости, тогда удобней взять вместо квадрата скоростей их кинетические энергии
Ex=1/2 movx2 , Eу , Ez
Тогда мы получаем φ(Ex)φ(Ey)φ(Ez)=f(Ex+Ey+Ez)
Найдём реш последнего функционального ур-ия: пусть Ez = const, тогда: Ex+ Eу= const
φ(Ex)φ(Ey) = const, прологорифмируем:
lnφ(Ex) + lnφ(Ey) = lnconst, продифф-ем:
φ’(Ex)/φ(Ex) + φ’(Ey)/ φ(Ey) = 0
Ex+ Eу= const → dEx+ dEу= 0
dφ(Ex)/φ(Ex) = dφ(Ey)/ φ(Ey)
Т.к Еx и Еу независимые компоненты то последние соотношение возможно, если:
dφ(Ex)/φ(Ex)=dφ(Ey)/φ(Ey)= - ά – определен в сравнении с основным уравнением МКТ.
ά = 1/Kt φ(Ex)φ(Ey)φ(Ez)=A13 e-άEx
A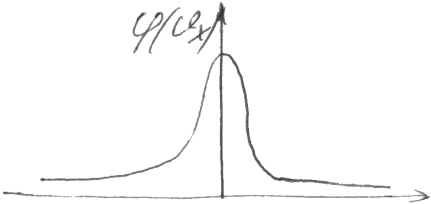 1
– получаем из условия нормировки:
1
– получаем из условия нормировки:
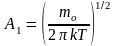
Функция распределения φ(vx). Такого рода функции, возникающие в теории ошибок, называются распределением гаусса. Оно возникает когда при измерении физ. величины действует множество малых по величине факторов. С учётом распределения можно получить ф-цию распределения: f(v)dv → dvxdvydvz = 4πυ2 dυ
4πυdυ*υ
О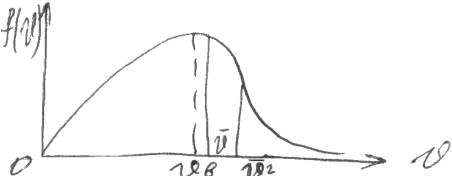 кончательно
распределение Максвелла имеет вид:
кончательно
распределение Максвелла имеет вид:
f(v)= (4/ π1/2)( mo/2kT)3/2 v2e-mv2/2kT
Очевидно это распределение:
υ→0 f(v) →0 υ→∞ f(v) →0
vв - вероятностная
vв = (2kT/ mo)1/2=(2RT/ μ)1/2
С редняя
арифметическая скорость молекулы:
(<v>)1/2=(8kT/πmo)1/2
=(8RT/πμ)1/2
редняя
арифметическая скорость молекулы:
(<v>)1/2=(8kT/πmo)1/2
=(8RT/πμ)1/2
k/mo = R/NAmo = R/μ
Средняя квадратическая скорость:
(<v>2)1/2=(3kT/mo)1/2=(3RT/ μ)1/2
Р ассмотрим
распределение максвелла при различной
температуре с ростом Т с фор-лы для
Vв следует что
максимум смещения вправо а величина
максимума будет убывать.
ассмотрим
распределение максвелла при различной
температуре с ростом Т с фор-лы для
Vв следует что
максимум смещения вправо а величина
максимума будет убывать.
З-н Максвелла для безразмерной скорости u = v/ vв ; f(u)=(4/ π1/2)u2e-u2
Распределение Максвелла было проверено эксперементально в 1920 в опыте Штейнера.
