
- •1О. Кинематика поступательного движения.
- •2О. Кинематика вращательного движения.
- •3О. Динамика частиц. Закон ньютона.
- •4О. Неинерциальные системы отсчета (нсо). Силы инерции.
- •5О. Основное ур-ние динамики вращательного движения тв. Тела.
- •7О. Закон сохранения импульса.
- •8О. Работа.Мощность.Кинетическая энергия системы.
- •9О. Потенциальная энергия системы.
- •10. Закон сохранения энергии в механике
- •11О. Закон сохранения момента импульса.
- •12О. Движение тела переменной массы.
- •13О. Кинематика гарманических колебаний
- •14О. Гармонический осциллятор.
- •15О. Примеры гармонических осцилляторов.
- •16. Сложение гармонических колебаний одного направления и частоты.
- •17. Сложение взаимно перпендикулярных гармонических колебаний.
- •18. Затухающие колебания.
- •19.Вынужденные колебания. Резонанс.
- •20.Упругие волны в средах.
- •21О.Бегущие волны. Фазовая скорость. Длина волны. Волновое число.
- •22. Одномерное волновое ур-е. Энергия волны.
- •23. Распространение волн в средах с дисперсией. Групповая скорость, ее связь с фазовой скоростью.
- •24. Стоячие волны
- •25. Элементы акустики.
- •26.Модуль Юнга. Скорость звука.
- •28. Постулаты сто. Преобразование
- •29. Средства преобразования Лоренца.
- •30. Релятивистский закон сложения скоростей.
- •31. Интервал между событиями и его инвариантность в преобразовании Лоренца
- •32. Релятивистская динамика, кинетическая энергия сто.
- •33. Связь массы, энергии, импульса в сто
- •34О. Эффект Доплера
- •35О. Принцип эквиваленности.Понятие о ото
- •36О. Равновесие и течение жидкости и газа
- •37О. Уравнение неразрывности струи. Уравнение Бернулли
- •38. Уравнение Эйлера. Движение идеальной жидкости.
- •39. Течение вязкой жидкости. Формула Стокса.
- •40. Течение вязкой жидкости в трубах. Формула Пуазейля.
- •41. Динамический и статистический закономерности в физике.
- •42. Уравнение состояния идеального газа.
- •43. Основное уравнение молекулярно-кинетической теории газов (мкт).
- •44. Молекулярно-кинетический смысл абсолютной температуры.
- •45. Распределение Максвелла.
- •46. Параметрическая формула распределения Больцмана.
- •47. Распределение Гиббса.
- •48. Первое начало термодинамики.
- •49. Теплоемкость многоатомных газов.
- •50. Применение I начала термодинамики к изопроцессам(термодинамическим процессам).
- •51. Адиабатический процесс.
- •52. Политропный процесс
- •53. Теплоемкость и работа газа в политропном процессе
- •54. Обратимые и необратимые процессы, круговой процесс, тепловые двигатели, холодильные машины.
- •55. Цикл Карно. Максимальный кпд тепловой машины.
- •56. Технические циклы.
- •57. Второе начало термодинамики (6 формулировок).
- •58. Энтропия
- •59.Принцип возрастания энтропии
- •60. Определение энтропии неравновесной системы через статистический вес состояния. III начало термодинамики.
- •61. Метод термодинамических потенциалов (характеристических функций).
- •62. Явления переноса. Средняя длина свободного пробега молекул.
- •63. Коэффициент диффузии.
- •64. Теплопроводность. Коэффициент теплопроводности.
- •65. Уравнение теплопроводности.
- •66. Вязкость. Коэффициент вязкости.
- •67. Фазовые равновесия и превращения. Фазы и фазовые превращения.
- •68. Уравнение Клайперона - Клаузиса.
- •69. Реальные газы. Уравнение Ван – дер - Вальса .
- •70. Изотермы Ван-дер-Ваальса. Критич. Состояние. Внутр. Энергия реального газа.
- •71. Твёрдые тела.Теплоёмкость кристалла
- •72. Жидкости.Поверхн. Натяж. Жидк.
- •73. Смачивание и капиллярные явления
- •74. Принцип динамич. Отопления
- •75. Элементы физики полимеров
- •1О. Кинематика поступательного движения.
42. Уравнение состояния идеального газа.
Широко используется модель идеального газа:
Газ называется идеальным, если молекулы газа имеет принебрежимо малый объем, в сравнении с объемом сосуда в котором заключен газ.
Молекулы не взаимодействуют друг с другом на расстоянии.
Столкновение молекул между собой и со стенками сосуда происходит по закону упругого удара, т.е выполняется закон сохранения импульса, момента импульса и энергии.
В промежутках между столкновениями молекулы движутся равномерно и прямолинейно, т.е по инерции.
Ур-е сост. газа – функциональная зависим. термодинам. параметров. Газ называется идеальным, если его состояние есть ур-е Клаперона- Менделеева: PV=(m/ μ)RT
P- давление ; V- объем ; μ – молярная масса
T= t C+273
R=8.31 Дж/моль.К
За единицу кол-ва в-ва в системе СИ принята 1 моль. Моль = кол-во в-ва ситемы, содержащая столько же структурных элементов, сколько содержится атомов в углероде С12 массой m=0,012кг. Моли различных веществ содержат одинаковое число молекул – число Авогадро: Na=6,02.1023. Моль-1
Ур-е К-М есть обобщение газовых законов: Бойля-Мариотта PV=const. Гей-Люссака V=const. Шарля Т=const.
При комнатных условиях воздух очень близок к идеальному.
Закон Дальтона: рассмотрим газ, состоящий из смеси различных газов. Парциальное давление газа называется давление, которое оказывал бы газ на стенке сосуда, как если бы другие газы отсутствовали и он 1 занимал этот обьем. Закон Дальтона: «давление смеси газов = сумме парциальных давлений отдельных газов».
р = р1 + р2 +…+ рп
рвоздуха = рN2 + рO2 + рCO2 + рH2O + …
43. Основное уравнение молекулярно-кинетической теории газов (мкт).
В основе МКТ лежат 3 основных положения:
1. все вещества состоят из атомов и молекул
2. атомы и молекулы непрерывно движутся
3. атомы и молекулы взаимодействуют с силами притяжения и отталкивания.
Различают 2 вида движения молекул газа:
упорядоченное
хаотическое или тепловое
Рассм. хар-ки теплового движения:
Пусть молекулы имеют одинаковую массу m0 и модули скоростей vi:Средняя арифметическая скорость молекул vcр=<v>=(v1+v2+v3…vn)/n
Средняя квадратичная скорость малекул: vкв=((v12+v22+…vn2)/n)1/2
Средняя кинетическа энергия поступательного движения молекул
<E>= mo <v>2/2
Р ассмотрим
одноатомный идеальный газ, заключенный
в сосуд в форме куба и вычеслим давление,
которое оказывает молекулы на стенки
сосуда. Покажем, что давление газа на
стенки сосуда обусловлено упругими
ударами молекул о стенки и последующей
передачи импульса молекулами стенке.
ассмотрим
одноатомный идеальный газ, заключенный
в сосуд в форме куба и вычеслим давление,
которое оказывает молекулы на стенки
сосуда. Покажем, что давление газа на
стенки сосуда обусловлено упругими
ударами молекул о стенки и последующей
передачи импульса молекулами стенке.
В силу хаотического характера движения молекул вдоль каждой из осей будет двигаться 1/3 молекул от общего числа, тогда вдоль положения Х будет двигаться 1/6 часть молекул.
П усть
все молекулы газа движутся с одной
скоростью vcр.
и пусть n-
концентрация молекул (число в единице
объема). На малую площадку ΔS
перпендикулярную оси Х за время Δt
ударится 1/6 часть всех молекул, заключенных
в цилиндре v.
Δt
и площадь основания ΔS.
Поскольку за это время все молекулы
успевают долететь до ΔS
и ударится и ударится о нее, число таких
молекул равно: ΔN=1/6v
Δt
ΔS
n
усть
все молекулы газа движутся с одной
скоростью vcр.
и пусть n-
концентрация молекул (число в единице
объема). На малую площадку ΔS
перпендикулярную оси Х за время Δt
ударится 1/6 часть всех молекул, заключенных
в цилиндре v.
Δt
и площадь основания ΔS.
Поскольку за это время все молекулы
успевают долететь до ΔS
и ударится и ударится о нее, число таких
молекул равно: ΔN=1/6v
Δt
ΔS
n
Т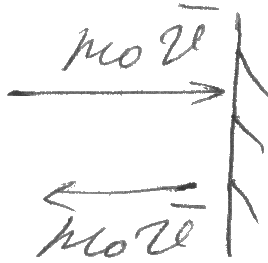 .к
удар молекулы о стенку упругий то импульс
передается молекулой стенке сосуда и
будет равен 2mov
.к
удар молекулы о стенку упругий то импульс
передается молекулой стенке сосуда и
будет равен 2mov
Тогда импульс, переданный стенке сосуда за время Δt : 2mov ΔN=2mov 1/6v Δt ΔS n (1)
По 2з Ньютона изменение импульса, задаваемого формулой 1 = импульсу силы давления : F Δt= Δ(mv) (2)
F=P ΔS P ΔS t = Δ(mv) (3) P=1/3 mon(v)2
Если учесть разброс скоростей молекул, их дисперсию то под квадратом средней скорости надо понимать квадрат средней квадратичной скорости, т.е (v)2=v2
Окончательно получаем основное ур-е МКТ:
Р =1/3monv2;ρ= mon; P=1/3ρv2 ; <E>=mo<v>2/2
P=(2/3)n<E> ; n=N/V ; PV=(2/3)N<E>
Давление идеального газа равно 2/3 средней кинет энергии поступательного движения молекул газа, заключенного в единице объема.V P = (2/3) N<E>
