
- •Фармацевтическая химия - лекция №1-2 Лекарственные вещества принадлежащие к группе алкалоидов. Производные хинолизина, пирролизидина, пипиридина, тропана, хинолина, изохинолина.
- •Методы выделения алкалоидов из растительного сырья
- •1. Выделение алкалоидов в виде солей. 2. Выделение алкалоидов в виде оснований.
- •Пахикарпина гидройодид (Pachycarpini hydroiodidum)
- •2. Аргентометрия (по hi). 3. Алкалиметрия (по hi). 4. Фотоколориметрия. Применение. Ганглиоблокатор; средство, стимулирующее мускулатуру матки. Хранение. В защищенном от света месте.
- •4. Определяют t° пл. (не ниже 195° с); удельное вращение от -71° до -73° (2,5% водный раствор); удельный показатель поглощения.
- •Алкалоиды производные пирролизидина
- •Алкалоиды производные бензилизохинолина
- •Дротаверина гидрохлорид но-шпа (Nospanum) Алкалоиды производные фенантренизохинолина
- •Лекарственные средства производные апорфина
- •Глауцина гидрохлорид (Glaucinihydrochloridum)
Фармацевтическая химия - лекция №1-2 Лекарственные вещества принадлежащие к группе алкалоидов. Производные хинолизина, пирролизидина, пипиридина, тропана, хинолина, изохинолина.
Алкалоиды - большая группа органических азотсодержащих веществ основного характера, главным образом растительного происхождения, реже животного, не являющихся продуктами распада белков и обладающих активным биологическим действием. Большинство алкалоидов по химическому строению являются производными различных азотсодержащих гетероциклов и относятся к третичным аминам.
Физические свойства алкалоидов Большинство алкалоидов - твердые кристаллические вещества, бесцветные, без запаха, горького вкуса. Некоторые алкалоиды в виде оснований являются жидкими веществами и обладают сильным неприятным запахом (колхицин, никотин, физостигмин). Большинство алкалоидов оптически активно. Алкалоиды-основания мало растворимы или практически нерастворимы в воде и хорошо растворимы в различных органических растворителях: спирте, эфире, бензоле и др. Соли алкалоидов, как правило, растворимы в воде и мало растворимы в органических растворителях. Исключение составляет спирт, который растворяет многие соли алкалоидов. Однако, из этого правила есть исключения: основания эфедрина, пилокарпина хорошо растворимы в воде, а некоторые соли - кокаина гидрохлорид и др. растворимы в хлороформе.
Методы выделения алкалоидов из растительного сырья
1. Выделение алкалоидов в виде солей. 2. Выделение алкалоидов в виде оснований.
Методы разделения алкалоидов 1 Дробная перегонка под вакуумом. 2.По различной растворимости алкалоидов-солей и оснований. 3. По различной силе основности алкалоидов. 4. На основании химических особенностей. 5. По различной адсорбционной способности.
Качественные реакции алкалоидов Для установления подлинности алкалоидов используют общие, групповые и частные или специфические реакции. Общие реакции основаны на способности алкалоидов как оснований давать простые или комплексные соли с различными, чаще комплексными кислотами, солями тяжелых металлов и др. Эти продукты, как правило, нерастворимы в воде, поэтому реактивы называют осадительными, а реакции - осадочными. Общеалкалоидные осадительные реактивы: 1. Раствор калия йодида йодированный (реактив Люголя, Вагнера, Бушарда). 2. Раствор калия йодвисмутата (реактив Драгендорфа). 3. Раствор ртути йодида в калия йодиде (реактив Майера). 4. Раствор кадмия йодида в калия йодиде (реактив Марме). 5. Фосфорномолибденовая кислота (реактив Зонненшгейна Н3РО4-12МоО3-2Н2О) - очень чувствительный реактив на алкалоиды и дает аморфные осадки желтоватого цвета, которые через некоторое время приобретают синее и зеленое окрашивание (вследствие восстановления молибденовой кислоты). 6. Фосфорновольфрамовая кислота (реактив Шейблера H3PO4-12WoO3-2H2O). 7. Кремневольфрамовая кислота (реактив Бертрана SiO2-12WoO3-4H2O). 8. Свежеприготовленный 5% раствор танина. 9. Насыщенный раствор пикриновой кислоты.
Перечисленные реактивы образуют осадки не со всеми алкалоидами, поэтому при определениях нельзя ограничиваться 1-2 пробами, а необходимо провести реакцию не менее чем с 4-5 реактивами. Аналитическое значение имеет лишь отрицательный результат этих реакций, поскольку с общеалкалоидными реактивами могут давать осадки и другие азотсодержащие органические вещества. Для алкалоидов также характерны цветные реакции со специальными реактивами. В основе этих реакций лежат следующие химические превращения: отнятие воды; окисление; отнятие воды и окисление одновременно; конденсация с альдегидами в присутствии водоотнимающих веществ. Специальные реактивы: 1. Концентрированная серная кислота. 2. Концентрированная азотная кислота. 3. Смесь концентрированных серной и азотной кислот (реактив Эрдмана). 4. Раствор молибдата аммония в концентрированной серной кислоте (реактив Фреде). 5. Раствор формальдегида в концентрированной серной кислоте (реактив Марки). 6. Раствор п-диметиламинобензальдегида в концентрированной серной кислоте (реактив Вазицки). Для некоторых алкалоидов эти реакции могут быть специфичными; проводят их с кристаллическими веществами в фарфоровых чашках.
Методы количественного определения алкалоидов 1. Метод ацидиметрии в неводных средах - принят для количественного определения, как солей, так и оснований. 2. Методы нейтрализации: а) прямое титрование оснований кислотами; б) обратное титрование оснований кислотами; в) титрование солей алкалоидов в водно-спиртовой среде щелочью в присутствии фенолфталеина (с применением и без применения органического растворителя для извлечения основания алкалоида). 3. Гравиметрический метод. 4. Методы, основанные на индивидуальных химических свойствах алкалоидов. 5. Физико-химические методы.
Классификация алкалоидов В настоящее время принята химическая классификация, в основу которой положен характер углеродно-азотистого скелета молекулы алкалоида. Различают следующие группы алкалоидов: 1. Алкалоиды, производные хинолизина(1) и хинолизидина (2)(цитизин, пахикарпин):
![]()
![]() 1
2
1
2
2.
Алкалоиды, производные тропана (атропин,
гиосциамин, скополамин, кокаин):
![]() 3.
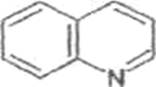
Алкалоиды, производные хинолина (хинин)
(1)
и изохинолина(опийные
алкалоиды) (2):
3.
Алкалоиды, производные хинолина (хинин)
(1)
и изохинолина(опийные
алкалоиды) (2):
![]() 1
2
4.
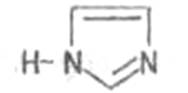
Алкалоиды, производные имидазола (пилокарпин):
1
2
4.
Алкалоиды, производные имидазола (пилокарпин):
 5.
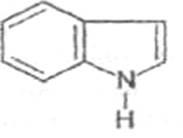
Алкалоиды, производные индола (гармин,
стрихнин, резерпин):
5.
Алкалоиды, производные индола (гармин,
стрихнин, резерпин):
 6.
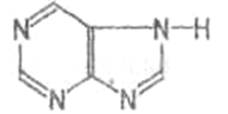
Алкалоиды, производные пурина (кофеин,
теобромин, теофиллин):
6.
Алкалоиды, производные пурина (кофеин,
теобромин, теофиллин):
 7.
Алкалоиды, производные 1-метилпирролизидина (платифиллин):
7.
Алкалоиды, производные 1-метилпирролизидина (платифиллин):
 8.
Алкалоиды, содержащие экзоциклический
азот (сферофизин,
эфедрин).
8.
Алкалоиды, содержащие экзоциклический
азот (сферофизин,
эфедрин).
Алкалоиды производные хинолизина и хинолизидина
Цитизин (Cyttsinum)
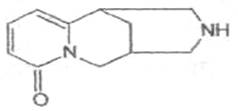 Можно
рассматривать как производное
1,2,3,4-тетрагидрохинолизона-6, который
конденсирован с пиперидином.
Можно
рассматривать как производное
1,2,3,4-тетрагидрохинолизона-6, который
конденсирован с пиперидином.
Свойства Белый или слегка желтоватый кристаллический порошок, легко растворим в воде, спирте, хлороформе. Температура плавления 154-157° С; удельное вращение от -120° до -123° (2% водный раствор).
Идентификация 1. Реакция нитрования ароматического кольца с последующим восстановлением нитрогруппы до аминогруппы и получением азокрасителя. 2. С раствором Со(NO3)2 - осадок голубовато-зеленого цвета. 3. С раствором FeCl3 - красное окрашивание, исчезающее при добавлении воды.
Количественное определение Ацидиметрия; индикатор — метиловый красный
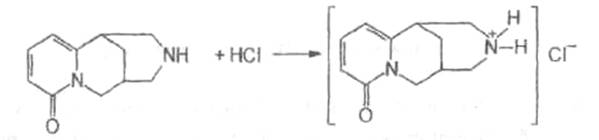 Применение.
Стимулятор дыхания и кровообращения.
Хранение. В
хорошо укупоренной таре, предохраняя
от действия влаги. Из цитизина готовят
0,15% водный раствор для инъекций - цититон.
Применение.
Стимулятор дыхания и кровообращения.
Хранение. В
хорошо укупоренной таре, предохраняя
от действия влаги. Из цитизина готовят
0,15% водный раствор для инъекций - цититон.
