
- •73.Фарм. Контроль качества воды очищенной и для иньекций.
- •75) Бария сульфат для рентгеноскопии.
- •76)Магния оксид и магния сульфат. Получение, свойства, контроль качества, хранение и медицинское применение.
- •81)Натрия гидрокарбонат (NaHco3 )
- •82). Кислота борная и натрия тетраборат. Получение, св-ва, контроль качества, хранение и медицинское применение.
- •84) Железа хлорид и меди сульфат
- •Меди сульфат. Получение, свойства, контроль качества, хранение и медицинское применение.
- •85)Вазелин.Получение,св-ва,контроль качества,хранение и мед.Применение.
- •87) Раствор формальдегида(формалин).Получение,свойства,контроль качества,хранение и мед.Применение
- •88)Моносахарид: глюкоза.Получение,свойства,контроль качества,хранение,мед. Применение
- •89) Кислота аскорбиновая Получение, контроль качества, хранение и мед. Применение.
- •90)Капльция глюконат, Получение, св-ва, контроль качества, хранение и мед. Применение.
- •91) Глицин
- •92) Ментол. Получение, свойства, контроль качества, хранение и медицинское применение.
- •93) Лекарственные в-ва группы фенолов: фенол, резорцин.
- •94) Производные п-аминофенола: парацетамол.
- •97) Сложные эфиры пара-аминобензойной кислоты: бензокаин, прокаина гидрохлорид.
- •98) Нитрофенилалкиламины: хлорамфеникол и его эфиры.
- •99) Сульфаниламид (стрептоцид) и сульфаниламиды, замещ. По амидной группе.
- •100) Нитрофурал (Nitrofural, Фурацилин)
- •101) Рутозид тригидрат (# рутин)
- •102) Метамизол-натрий. Получение, св-ва, контроль кач-ва, хранение и мед. Применение.
- •104) Папаверина гидрохлорид:.
- •105) Кофеин.Получение,св-ва,контроль качества,хранение и мед.Применение.
- •106) Аминофиллин. Получение, св-ва, контроль качества, хранение и мед.
- •107) Кислота фолиевая (Acidum folicum, Folic acid)
- •108) Рибофлавин (# витамин в2) Ribofl avinum riboflavin
76)Магния оксид и магния сульфат. Получение, свойства, контроль качества, хранение и медицинское применение.
Д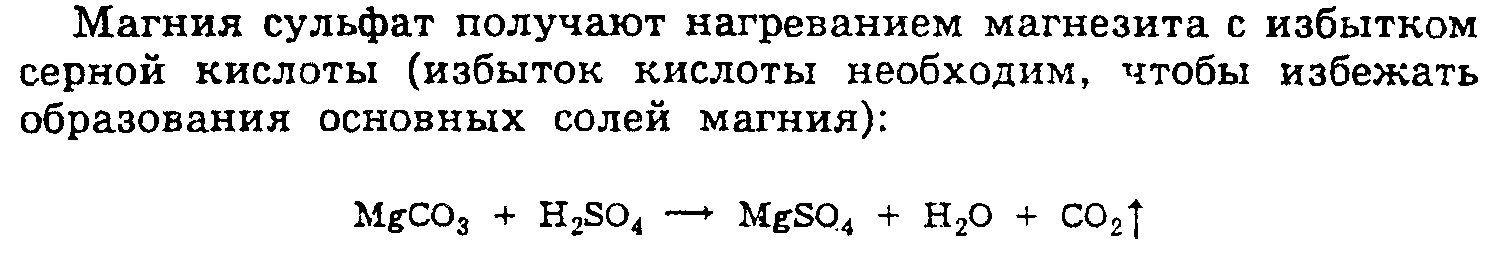 ля
получения препаратов магния используют
минералы (магнезит(MgCo3),
эпсомит-MgSO4*7H2O,
кизерит-MgSO4*H2O,
доломит-MgCa(CO3)2),
а также природные и искусственные
рассолы, содержащие соли магния. Магния
оксид получают при обработке природных
солевых рассолов гидроксидом кальция
(известковым молоком). Образуется
гидроксид магния, который превращают
в оксид термисеской обработкой (при 500
град.):
ля
получения препаратов магния используют
минералы (магнезит(MgCo3),
эпсомит-MgSO4*7H2O,
кизерит-MgSO4*H2O,
доломит-MgCa(CO3)2),
а также природные и искусственные
рассолы, содержащие соли магния. Магния
оксид получают при обработке природных
солевых рассолов гидроксидом кальция
(известковым молоком). Образуется
гидроксид магния, который превращают
в оксид термисеской обработкой (при 500
град.):
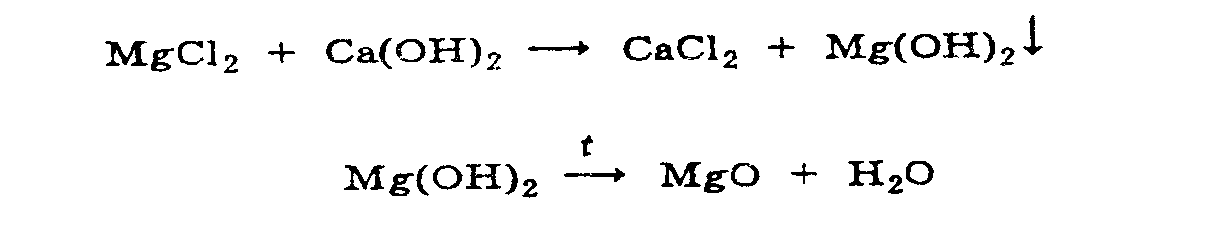
М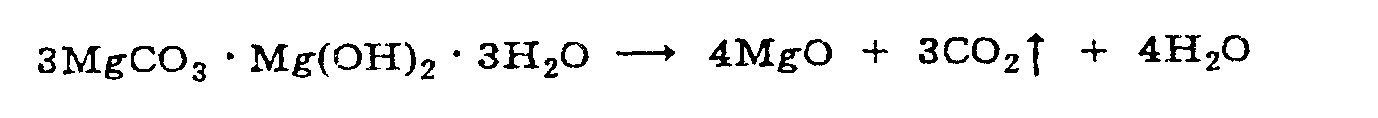 агния
оксид получают обработкой основного
карбоната магния при температуре
900-1000 градусов.
агния
оксид получают обработкой основного
карбоната магния при температуре
900-1000 градусов.
Магния оксид -практически нерастворим в воде (свободной от примеси углекислого газа) и в этаноле, но растворим в разведеных к-тах. Магния оксид – белый мелкий легкий порошок без запаха.
Магния сульфат легко растворим в воде, практически нерастворим в этаноле.-бесцетные призматические кристаллы
И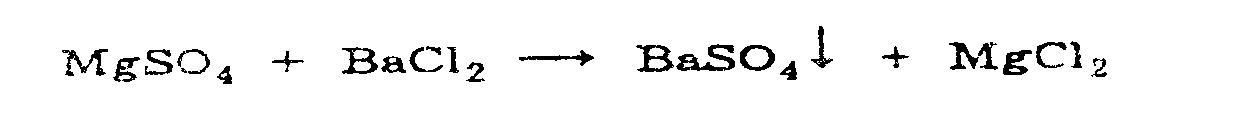 он
магния в магния оксиде обнаруживают,
осаждаяего из р-ров препаратов в соляной
к-те избытком гидроксида натрия.
Образующийся гидроксид магния - белый
студенистый осадок, нерастворимый в
избытке р-ра гидроксида натрия. Если
затем добавить несколько капель иода,
то осадок приобретает темно-коричневую
окраску.
он
магния в магния оксиде обнаруживают,
осаждаяего из р-ров препаратов в соляной
к-те избытком гидроксида натрия.
Образующийся гидроксид магния - белый
студенистый осадок, нерастворимый в
избытке р-ра гидроксида натрия. Если
затем добавить несколько капель иода,
то осадок приобретает темно-коричневую
окраску.
В магния сульфате также устанавливают наличие сульфат-ионов:
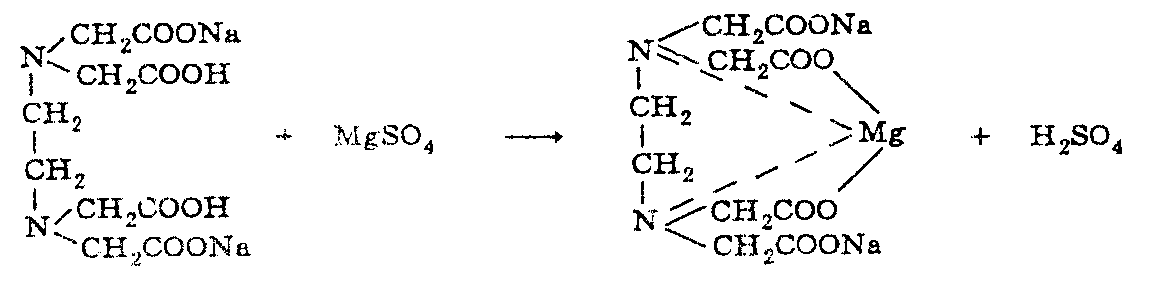
Препараты магния количественно определяют прямым комплексонометрическим методом с использованием индикатора эриохрома черного Т.
Так как выделяется серная кислота, то для поддержания Рн среды используют аммиачный буферный р-р. Изменение красно-фиолетовой окраски на синюю.
Препараты хранят в хорошо укутанной таре, т.к. магния окись взаим-ет с углекислым газом и влагой, содержащейся в воздухе, и образуетс примесь карбоната и гидроксид магния.
Магния сульфат в плохо укупоренной таре постепенно теряет кристаллическую воду.
Магния окись в дозах 0,5-1-3 г. Применяют при повышенной кислотности желудочного сока.
Магния сульфат проявляет слабительный эффект при введении внутрь больших доз (10-30 г.). При парентеральном введении 20-25%-ных р-ров магния сульфат оказывает успокаивающее действие, поэтому его назначают как седативное, противосудорожное, спазмолитическое ср-во.
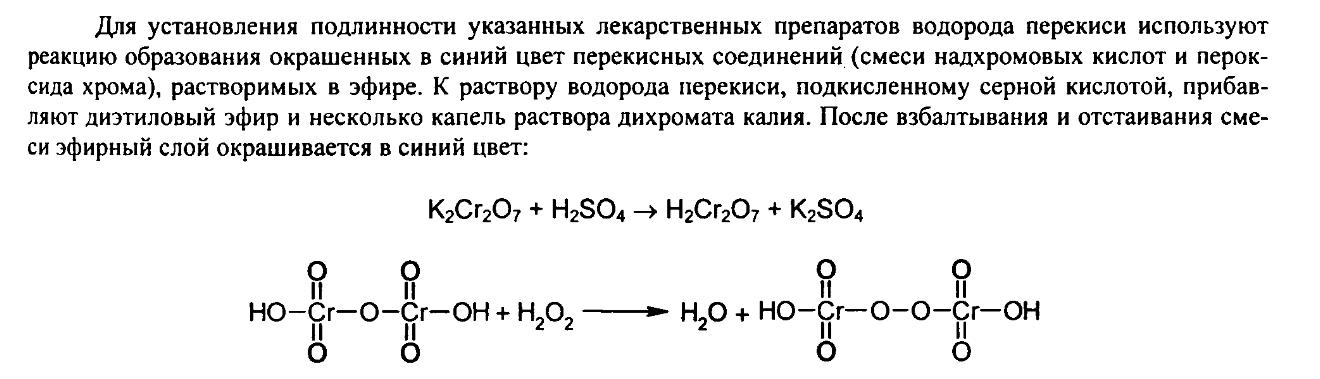
77)Водорода пероксид.его р-ры.физ,хим св-ва,получение,стабильность,контроль качества,хранение и мед.применение.
H2O2- бесветная прозрачная жидкость без запаха
Магния перикись(MgO2+MgO)-белый легкий порошок,практически нерастворимый в воде.
Гидроперит-
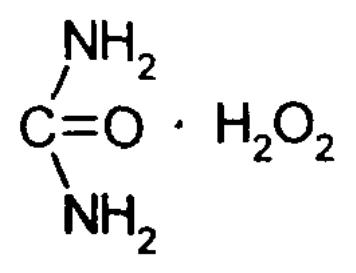

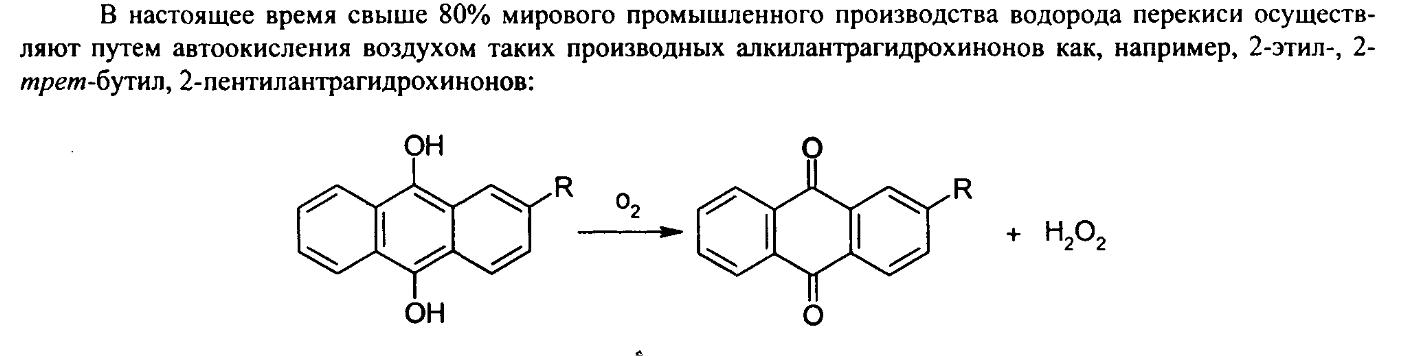
Получение:
![]()

В химическом отношении H2O2 –очень слабая к-та.Проявляет как окислит.,так и восстановит. Свойства.
![]()
![]() -слой
хлороформа окр-ся в фиолетовый цвет.
-слой
хлороформа окр-ся в фиолетовый цвет.


78) Йод.
Получение: 2I + 2NaNO2 + H2SO4= I2 + 2NO + 2Na2SO4 + H2O
2I2 + 6NaOH = 5NaI+NaIO+3H2O
5NaI+NaIO+3H2SO4=3I2+3Na2SO4+3H2O
2NaI+Cl2=2NaCl+I2
Очистка методом сублимации, конденсат на стенках скалывают
Серовато-черный, с металлич. Блеском, кр. в-во. Летуче при комнатной температуре, при нагревании лает фиолетовые пары. Очень мало р-рим в воде, легко в водном р-ре KI, р-рим в 10 частях спирта, в эфире, хлороформе (фиолет. цв.).
Подлинность: р-р в воде от прибавления 1 кап крахмала окрашивается в синий. При кипячении окраска исчезает.
Чистота: прозрачность и цветность (в 10% р-ре тиосульфата натрия).
ICN+2NaOH=NaCN+NaIO+H2O
2NaCN+FeSO4=Fe(CN)2+Na2SO4
Fe(CN)2+4NaCN=Na4[Fe(CN)6]
Na4[Fe(CN)6]+FFeCl3=NaFe[Fe(CN)6]+3NaCl (синее окр)
I2+H2SO4+H2O=2HI+H2SO4
Опр хлориды, подкисляя азотной к-той и прибавляя нитрат серебра.
Количественное определение: тиосульфатометрия, растворяя в KI, прямое титрование. Интдикатор-крахмал.
Список Б, банки темного стекла, прохладное место.
Применение: в виде спиртового р-ра, для растираний при ревматических болях в суставах.
Спиртовой р-р йода 5%: прозрачная жидкость красно-бурого цвета с хар-ным запахом.
Подлинность опр с помощью крахмала, кол-венное опр – тиосульфатометрия (титруют до обесцвечивания без индикатора, рассчитывают содержание йода, доб воду, разведенную уксусную к-ту, р-р эозината натрия, титруют нитратом серебра до перехода окр из желтой в розовую.
Хранение: список Б, склянки оранжевого стекла.
Йодиды калия и натрия.
Получение: Fe+4I2=FeI2+2FeI3
Fe3I4+4Na2CO3+2H2O=8NaI+2Fe(OH)3+Fe(OH)2+4CO2
Отфильровывают гидроксиды, фильтрат подкисляют иодистоводородной к-той и упаривают до кристаллизации.
Na2CO3+2HCOONa+2I2=4NaI+3CO2+H2O
Описание: белые мелкокр порошки без запаха солено-горького вкуса. На влажном воздухе отсыревают, на свету разлагаются с выделением йода, окр препарат в желтый цвет, р-рим в воде, спирте, глицерине.
Подлинность: р-ция калия с винной к-той, р-ция йодида с разведенной серной к-той, хлоридом железа и хлороформом:
2I+2Fe3+ = I2+2Fe2+ (хлороформный слой окр в фиолетовый цвет)
Чистота: прозрачность и цветность, щелочность, сульфаты, цианиды, барий, тяжелые металлы, мышьяк, железо, нитраты.
ICN+2NaOH=NaCN+NaIO+H2O
2NaCN+FeSO4=Fe(CN)2+Na2SO4
Fe(CN)2+4NaCN=Na4[Fe(CN)6]
Na4[Fe(CN)6]+FFeCl3=NaFe[Fe(CN)6]+3NaCl (синее окр)
Кол-венное опр: аргентометрия, прямое титрование, индикатор – эозинат натрия.
Хранение: хорошо укупоренные банки оранжевого стекла
Применение: KI 3% и таблетки - при недостатке йода в орг-ме, водные р-ры при бронхиальной астме, нельзя назначать внутривенно из-за угнетающего действия на сердце.
NaI 10%– можно назначать внутривенно.
79) Хлориды щел. Ме: NaCl, KCl, способы получения, физ. и хим. св-ва, контроль кач-ва, хранение и мед. применение. NaCl получают из воды озер и морей выпариванием, отделяют от осадка декантацией, нагревают, затем производят очистку, избавляясь от примесей солей Mg, Ca и Ba: Na2SO4 +BaCl2 BaSO4↓+ 2NaCl NaHPO4 + BaCl2 BaHPO4↓ + 2NaCl MgCl2 + Na2CO3 MgCO3↓ + 2NaCl CaCl2 + Na2CO3 CaCO3↓+ 2NaCl BaCl2 + Na2CO3 BaCO3↓ + 2NaCl Р-р снова декантируют, затем удаляют карбонаты: Na2CO3 + HCl 2NaCl + CO2↑ + H2O Р-р упаривают до кристаллизации, кристаллы отфильтр. и высушивают. Источники получения KCl – минералы сильвинит KCl'NaCl или карналлит KCl'MgCl2’6H2O, выделяют методом флотации, а затем очищают, как и NaCl. NaCl – белые кристаллы или порошок без запаха, соленого вкуса. KCl – бесцв. кристаллы или белый крист. порошок без запаха, соленого вкуса. Na+ окрашивают бесцв. пламя горелки в желтый цвет и по образованию зеленовато-желтого кристаллич. осадка в реакции: NaCl + Zn[(UO2)3(CHCOO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CHCOO)9] · 9H2O↓ + HCl K+ окрашивают бесцв. пламя горелки в фиолетовый цвет. Также по р-ям: KBr + COOH-CHOH-CHOH-COOH COOK-CHOH-CHOH-COOH↓ + HBr 2KBr + Na3[Co(NO2)6] K2Na[Co(NO2)6]↓ + 2NaBr Галогенид-ионы обнаруж. с помощью осадочной реакции с р-ром AgNO3. NaCl + AgNO3 AgCl↓(белый) + NaNO3 AgCl + 2NH4OH [Ag(NH3)2]Cl + 2H2O Проверяют наличие примесей бромат-, иодат-, цианид-, тиосульфат-, сульфит- и нитрат-ионов. 5KBr + KBrO3+ 3H2SO4 3Br2 + 3K2SO4 + 3H2O (жёлтое окраш.) --//-- для иодатов. I2 + Na2SO4 + H2O Na2SO4 + 2HI I2 + 2Na2S2O3 2NaI + Na2S4O6 (Синее окраш. должно появляться после доб. не более 1 кап. 0,1 н. р-ра I2.) Zn + 2NaOH Na2ZnO2 + H2↑ 4H2 + NaNO3 NH3↑ + NaOH + 2H2O Колич. метод опред-я: аргентометрический (метод Мора). NaCl + AgNO3 AgCl↓ + NaNO3 2AgNO3 + K2CrO4 Ag2CrO4↓ (оранжево-красный) + 2KNO3 Также можно использовать метод ионообменной хроматографии. Препараты хлоридов хранят в сухом месте в плотно укупоренных банках (NaCl может содержать до 4-5% влаги). NaCl – осн. Часть солевых и коллоидно-солевых р-ров (в кач-ве плазмозамещающих жидкостей). Применяют наружно и внутривенно гипертонич. р-ры NaCl (3, 5 и 10%) и изотонич. 0,9% р-р. KCl – антиаритмическое ср-во и источник K+ (при гипокалиемии). Также входит в состав плазмозамещающих жидкостей.
80) Бромиды щел. Ме: NaBr, KBr, способы получения, физ. и хим. св-ва, контроль кач-ва, хранение и мед. применение. 1 способ: 3Fe + 4 Br2 Fe3Br8. Р-р бромида железа (ll) или (lll) нагревают до кипения, затем Fe3Br8 + 4Na2CO3 + 4H2O 8NaBr + 2Fe(OH)3↓+ Fe(OH)2↓+ 4CO2↑ 2 способ: Na2CO3 + 2HCOONa + 2Br2 4NaBr + 34CO2↑ + H2O NaBr – белый крист. порошок без запаха, соленого вкуса, гигроскопичен. KBr – бесцв. или белые кристаллы или мелкокрист. порошок без запаха, соленого вкуса. Na+ окрашивают бесцв. пламя горелки в желтый цвет и по образованию зеленовато-желтого кристаллич. осадка в реакции: NaCl + Zn[(UO2)3(CHCOO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CHCOO)9] · 9H2O↓ + HCl K+ окрашивают бесцв. пламя горелки в фиолетовый цвет. Также по р-ям: KBr + COOH-CHOH-CHOH-COOH COOK-CHOH-CHOH-COOH↓ + HBr 2KBr + Na3[Co(NO2)6] K2Na[Co(NO2)6]↓ + 2NaBr Галогенид-ионы обнаруж. с помощью осадочной реакции с р-ром AgNO3. NaBr + AgNO3 AgBr↓ (светло-жёлтый) + NaNO3 AgBr + 2NH4OH [Ag(NH3)2]Br + 2H2O Бромиды также обнаруж. С помощью р-ий окисления до свободных галогенов, галогены извлекают хлороформом и наблюдают окраску хлороформного слоя. C6H5SO2NNaCl + 2HCl Cl2 + NaCl + C6H5SO2NH2 2KBr + Cl2 Br2 + 2KCl Проверяют наличие примесей бромат-, иодат-, цианид-, тиосульфат-, сульфит- и нитрат-ионов. 5KBr + KBrO3+ 3H2SO4 3Br2 + 3K2SO4 + 3H2O (жёлтое окраш.) --//-- для иодатов. I2 + Na2SO4 + H2O Na2SO4 + 2HI I2 + 2Na2S2O3 2NaI + Na2S4O6 (Синее окраш. должно появляться после доб. не более 1 кап. 0,1 н. р-ра I2.) Zn + 2NaOH Na2ZnO2 + H2↑ 4H2 + NaNO3 NH3↑ + NaOH + 2H2O Колич. метод опред-я: аргентометрический (метод Мора) NaBr + AgNO3 AgBr↓ + NaNO3 2AgNO3 + K2CrO4 Ag2CrO4↓ (оранжево-красный) + 2KNO3
Также можно использовать метод ионообменной хроматографии. Препараты бромидов предохр. от действия света – в склянках оранж. стекла. Калиевые соли менее гигроскопичны (до 1% влаги), чем препараты хлоридов. NaBr и KBr: седативные ср-ва и внутривенно, выпуск в виде ампул 5, 10 т 20% по 10 мл.
