
- •73.Фарм. Контроль качества воды очищенной и для иньекций.
- •75) Бария сульфат для рентгеноскопии.
- •76)Магния оксид и магния сульфат. Получение, свойства, контроль качества, хранение и медицинское применение.
- •81)Натрия гидрокарбонат (NaHco3 )
- •82). Кислота борная и натрия тетраборат. Получение, св-ва, контроль качества, хранение и медицинское применение.
- •84) Железа хлорид и меди сульфат
- •Меди сульфат. Получение, свойства, контроль качества, хранение и медицинское применение.
- •85)Вазелин.Получение,св-ва,контроль качества,хранение и мед.Применение.
- •87) Раствор формальдегида(формалин).Получение,свойства,контроль качества,хранение и мед.Применение
- •88)Моносахарид: глюкоза.Получение,свойства,контроль качества,хранение,мед. Применение
- •89) Кислота аскорбиновая Получение, контроль качества, хранение и мед. Применение.
- •90)Капльция глюконат, Получение, св-ва, контроль качества, хранение и мед. Применение.
- •91) Глицин
- •92) Ментол. Получение, свойства, контроль качества, хранение и медицинское применение.
- •93) Лекарственные в-ва группы фенолов: фенол, резорцин.
- •94) Производные п-аминофенола: парацетамол.
- •97) Сложные эфиры пара-аминобензойной кислоты: бензокаин, прокаина гидрохлорид.
- •98) Нитрофенилалкиламины: хлорамфеникол и его эфиры.
- •99) Сульфаниламид (стрептоцид) и сульфаниламиды, замещ. По амидной группе.
- •100) Нитрофурал (Nitrofural, Фурацилин)
- •101) Рутозид тригидрат (# рутин)
- •102) Метамизол-натрий. Получение, св-ва, контроль кач-ва, хранение и мед. Применение.
- •104) Папаверина гидрохлорид:.
- •105) Кофеин.Получение,св-ва,контроль качества,хранение и мед.Применение.
- •106) Аминофиллин. Получение, св-ва, контроль качества, хранение и мед.
- •107) Кислота фолиевая (Acidum folicum, Folic acid)
- •108) Рибофлавин (# витамин в2) Ribofl avinum riboflavin
94) Производные п-аминофенола: парацетамол.
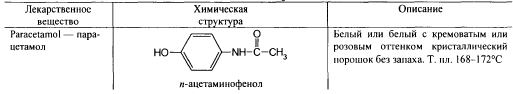
Парацетамол емеренно р-рим в воде, легко р-м в этаноле,р-м в ацетоне и р-рах едких щелочей, практически нер-рим в эфире.
Подлинность парацетамола подтверждают по ИК-спектру и УФ-спектру.
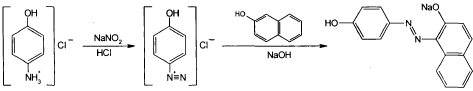
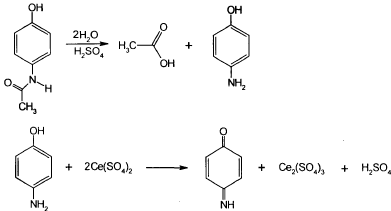
Синтез
парацетамола выполняют ацетилированием
п-аминофенола уксусным ангидридом:
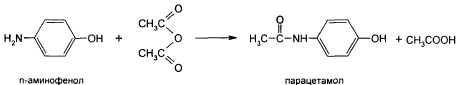
Известен также способ синтеза парацетамола из фенола:
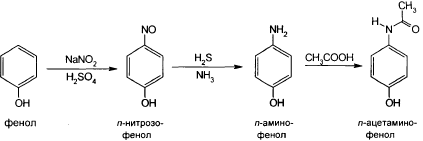
Цветную р-ю с хлоридом железа (3) используют для испытания подлинности парацетамола, в присутствии которого возникает сине-фиолет. окрашивание.
При действии р-ром дихромата калия и разведенной хлороводородной кислотой в присутствии парацетамола появляется неизменяющееся фиолетовое окрашивание:
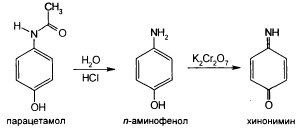
Непрореагировавший п-аминофенол при взаимодействии с зинонимином образует индофенол.
Р-р парацетамола при действии азотной кислотой приобретает желто-бурую окраску. Наличие свободного фенольного гидроксила придает р-рам парацетамола восстанавливающие свойства. Поэтому при его нагревании с аммиачным р-ром нитрата серебра выпадает серый осадок серебра.
Под
действием реактива Марки парацетамол
приобретает буро-красное окрашивание.
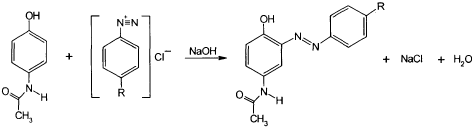
Парацетамол
также образует красного цвета азосоединение
с диазореактивом за счет наличия в
молекуле фенольного гидроксила:
Парацетамол подвергают контролю на содержание примесей промежуточных продуктов синтеза. Обнаруживают допустимое кол-во примеси п-хлорацетанилида методом ТСХ. Устанавливают также содержание примеси свободного п-аминофенола.
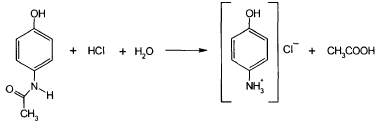
Парацетамол при кипячении с разведенной HCl или H2SO4 вследствие гидролиза выделяет уксусную кислоту, которую можно обнаружить по запаху:
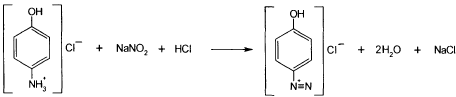
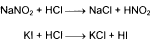
Парацетамол количественно определяют по образующемуся при кипячении с обратным холодильником в течении 1 часа продукту кислотного гидролиза- гидрохлориду п-аминофенола используя нитритометрический метод:
Эквивалентную точку устанавливают потенциометрически или с помощью внешнего индикатора йодокрахмальной бумаги:
![]()
Эквивалентную точку при нитритометрическом определении можно также установить со смешанным внутренним индикатором, содерж. 0,1% р-р тропеолина 00 и 0,15% р-р метиленового синего.
парацетамол можно колич. определить в неводной среде. Р-лем служит безводный ацетон, титрантом гидроксид калия в изопропиловом спирте. Эквивалентную точку устанавливают потенциометрическим методом. Способ обратного цериметрического определения основан на предварительном кислотном гидролизе и последующем окислении п-аминофенола избытком 0,1М р-ра сульфата церия:
точку
эквивалентности устанавливают
йодометрическим методом, добавляя 10%
р-р иодида калия и титруя выделившийся
йод 0,1М р-ром тиосульфата натрия:
![]()
В лекарственных формах парацетамол определяют спектрофотометрическим методом и методом ГЖХ.
Фотоколориметрический метод окисления парацетамола основан на образовании молибденовой сини.
парацетамол хранят по списку Б, в хорошо укупоренной таре в сухом месте. Предохраняют от действия света, чтобы не допустить гидролиза и окисления.
парацетамол применяют в качестве жаропонижающего и болеутоляющего средства.
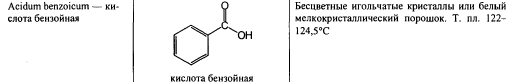
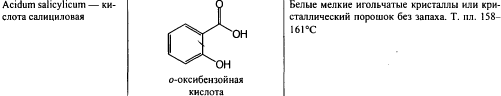
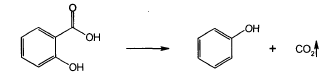
95-96) Ароматические к-ты: кислота бензойная, кислота салициловая.

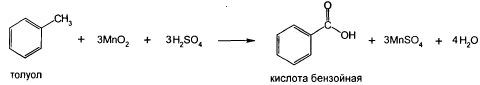
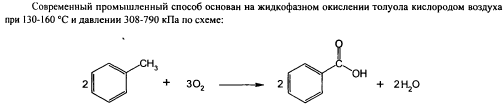
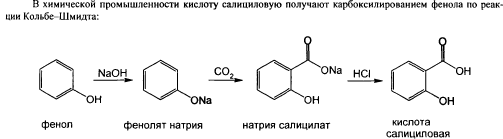
![]()
![]()
![]()
![]()
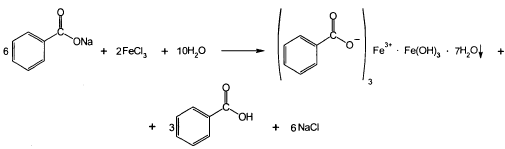
![]()



![]()

![]()
![]()
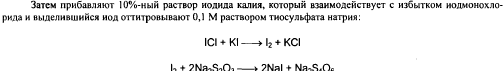
![]()
![]()
![]()
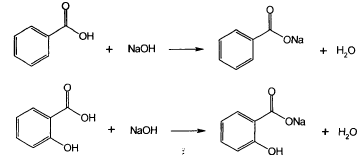
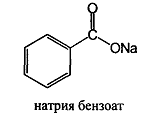
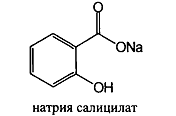
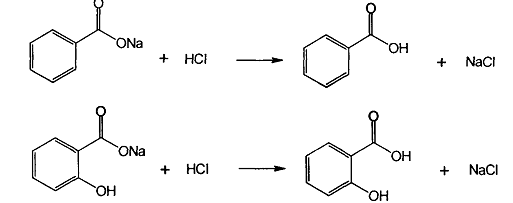
Соли ароматических кислот: натрия бензоат, натрия салицилат.
Натрия бензоат – Natrii benzoas – белый мелкокристаллический порошок без запаха или с очень слабым запахом. Натрия салицилат – Natrii salicylas –белый кристаллический порошок или мелкие чешуйки без запаха
легко растворимы в воде,в водных растворах ведут себя как соли сильных оснований и слабых кислот – диссоциируют на ионы натрия и бензоат или салицилат ионы. Натрия бензоат и натрия салицилат получают выпаривая досуха раствор соответствующей кислоты, нейтрализованной эквивалентным количеством карбоната или гидрокарбоната натрия:
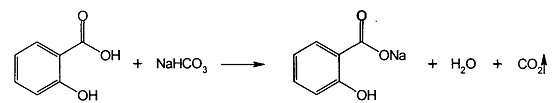
В этаноле натрия салицилат растворим, а натрия бензоат – умеренно растворим. Обе соли практически нерастворимы в эфире. Натрия салицилат легко, но медленно растворим в глицерине. Подлинность натрия салицилата подтверждают с помощью ИК-спектра в области 4000-400 см-1.(спрессованный в таблетках вместе с бромидом калия), который должен полностью совпадать со спектром ФС.УФ-спектр водного раствора натрия бензоата в области 220-300 нм должен иметь максимум поглащения при 226 нм. Натрия бензоат дает характерную реакцию с р-ром хлорида железа(III). Образуется бензоат железа розово-желтого цвета.
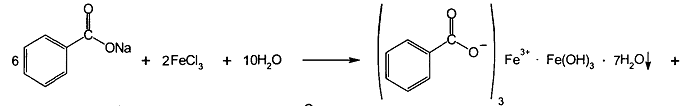
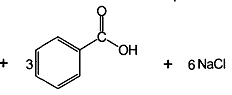
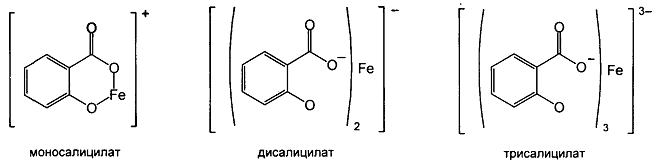
Для испытания подлинности натрия салицилата также используют в качестве реактива раствор хлорида железа(III). Окраска и состав образующихся комплексов непостоянны и зависят от соотношения ЛВ и реактива, рН среды. рН 2-3 – фиолетовый моносалицилат железа(III), 3-8-красный дисалицилат, 8-10- желтого цвета трисалицилат:
При добавлении минеральных кислот комплексы разрушаются, окраска исчезает и выпадает белый осадок салициловой кислоты. Бензоат и салицилат ионы вступают в реакции и с другими солями тяжелых металлов. Белый осадки образуются при взаимодействии с раствором нитрата серебра. С раствором сульфата меди натрия салицилат образует зеленого цвета салицилат меди:
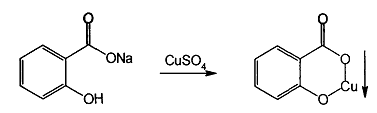
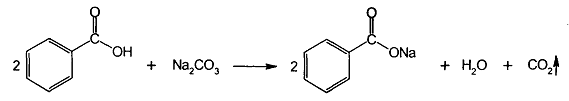
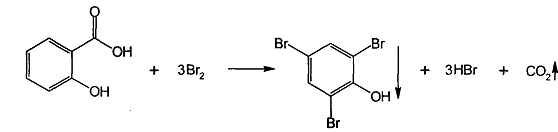
При нагревании натрия салицилата с конц. Серной кислотой и ментолом возникает характерный резкий запах метилсалицилата. Подлинность натрия беноата и натрия салицилата устанавливают по иону натрия(окраска бесцветного пламени горелки в желтый цвет) и по выделению соотв. Кислот после нейтрализации растворов натриевых солейразведенной азотной кислотой. Выделевшийся осадок отфильтровывают, промывают водой, сушат и идентифицируют по Тплавления(120-124,5-у бензойной кислоты, 156-161-салициловой). Испытания на чистоту- отсутствие или допустимые пределы примесей исходных или промежуточных продуктов синтеза (фталевая кислота, фенол, оксидифенил), а также восстанавливающих веществ и органических примесей, кислотность и щелочность, прозрачность и цветность, микробиологическую чистоту. Количественное определение – ацидиметрический метод. Титруют раствором хлороводородной кислоты, используя смешанный индикатор – МО+МС 1:1. Титрование ведут в присутствии эфира, т.к. выделяющаяся кислота (бензойная или салициловая) изменяет рН водного раствора до 2-3. Это приводит к изменеию окраски индикатора до ТЭ.Эфир это предотвращает.
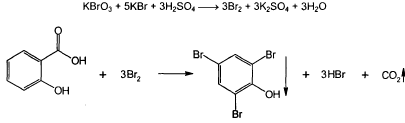
Количественное определение натрия салицилата бромид-броматометрическим методом:
![]()
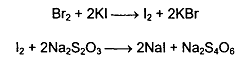
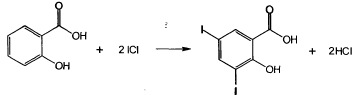
Количественное определение натрия салицилата иодхлорметрически:
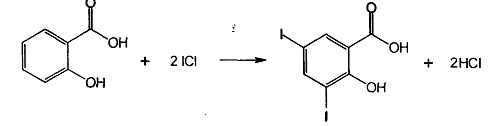
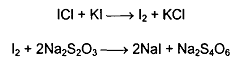
Натрия салицилат определяют также методом неводного титрования в среде ледяной уксусной кислоты(титрант 0,1М НСl, индикатор-кристаллический фиолетовый).
Хранение- сухое, защ. от света место, при комнатной температуре, в хорошо укупоренной таре.
Применение- натрия бромид-отхаркивающее(микстуры или внутривенно 15 % раствор). Натрия салицилат- противоревматическое, противовоспалительное, болеутоляющее и жаропонижающее действие при приеме внутрь в дозах 0,5-1,0г.
