Застосування першого закону термодинаміки до ідеального газу. Адіабатний процес
Розглянемо застосування першого закону термодинаміки до описаних вище процесів зміни стану ідеального газу.
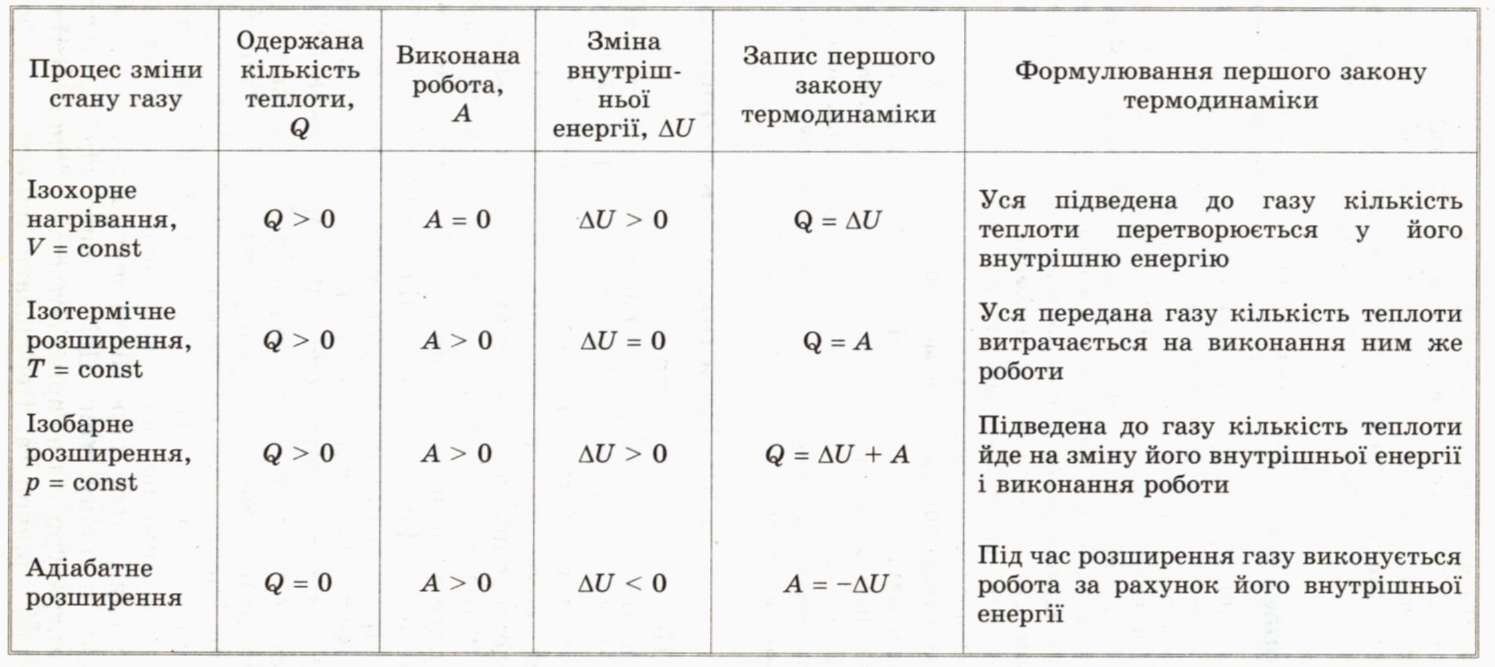
Ізохорний процес. Нехай ідеальний газ міститься в циліндрі із закріпленим поршнем (мал. 69, а). Надамо газові певну кількість теплоти Q. Оскільки в цьому випадку його об’єм залишається сталим (V2 –V1= 0; мал. 69, б), робота розширення дорівнює нулеві і формула першого закону термодинаміки набуває вигляду:
Q U
U
Якщо газ нагрівається, то б Q> 0 і U>0 — внутрішня енергія газу зростає. Під час охолодження газу його внутрішня енергія зменшується.
Таким чином, у разі ізохорної зміни стану газу вся кількість підведеної до нього теплоти йде на зміну внутрішньої енергії газу.
 Ізотермічний
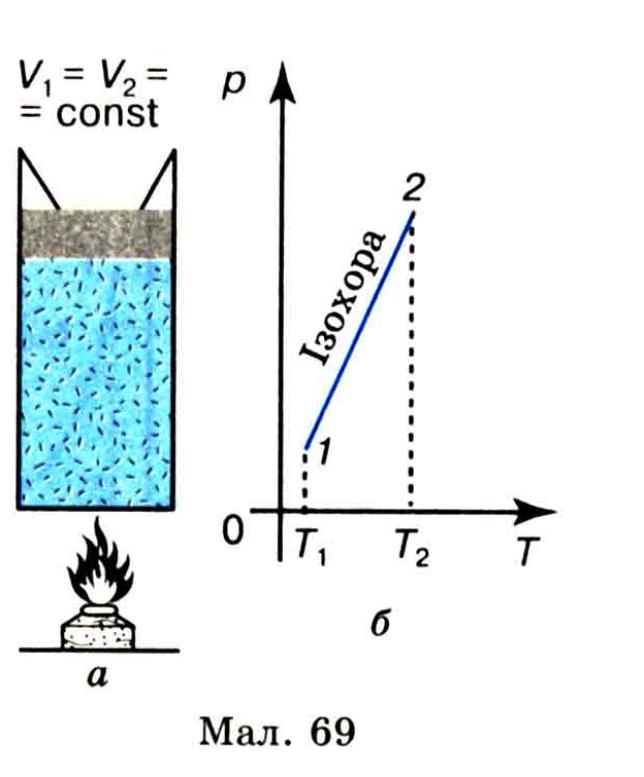
процес. Помістимо
газ у циліндрі з легкорухомим поршнем
в термостат (мал.
70,
а),
в
якому підтримується стала температура.
Надамо газові можливість розширятися,
але щоб його температура не знизилася,
він повинен дістати від термостата
кількість теплотиQ.
Оскільки внутрішня енергія ідеального
газу не залежить від об’єму, то у разі
ізотермічної зміни стану його внутрішня
енергія залишається незмінною
Ізотермічний
процес. Помістимо
газ у циліндрі з легкорухомим поршнем
в термостат (мал.
70,
а),
в
якому підтримується стала температура.
Надамо газові можливість розширятися,
але щоб його температура не знизилася,
він повинен дістати від термостата
кількість теплотиQ.
Оскільки внутрішня енергія ідеального
газу не залежить від об’єму, то у разі
ізотермічної зміни стану його внутрішня
енергія залишається незмінною
( U
= 0), і рівняння першого закону термодинаміки
записується так:
U
= 0), і рівняння першого закону термодинаміки
записується так:
Q = A
З цього виразу випливає, що під час ізотермічного процесу вся підведена до газу кількість теплоти витрачається на виконання газом роботи. У процесі ізотермічного розширення ідеальний газ виконує роботу проти зовнішніх сил за рахунок набутої кількості теплоти; під час ізотермічного стискання зовнішні сили виконують роботу, а газ віддає навколишньому середовищу еквівалентну кількість теплоти.
Нагадаємо, що робота газу під час ізотермічного процесу чисельно дорівнює площі (мал. 70, б), обмеженій ізотермою і вертикальними прямими для початкового р1 1 кінцевого р2 станів газу.
Ізобарний процес. Для цього нагріватимемо газ у циліндрі з поршнем, який вільно переміщається у ньому (мал. 71, а). Надана газу кількість теплоти частково переходить у внутрішню енергію системи, а частково витрачається на виконання роботи — підняття поршня:
Q = U + A
У разі ізобарного розширення кількість підведеної до газу теплоти більша за виконану ним роботу на величину, яка дорівнює зростанню його внутрішньої енергії. Робота газу під час ізобарного процесу чисельно дорівнює площі прямокутника (мал. 71, б), обмеженого ізобарою, віссю об’ємів та ізохорами, які відповідають початковому V1 і кінцевому V2 станам газу.
Адіабатний процес. Вам, напевне, доводилося накачувати насосом велосипедну шину або волейбольний м’яч і ви спостерігали, що насос при цьому сильно нагрівається. Таке підвищення температури відбувається не внаслідок тертя поршня об стінки насоса, яке дуже мале, а завдяки нагріванню повітря від стискання.
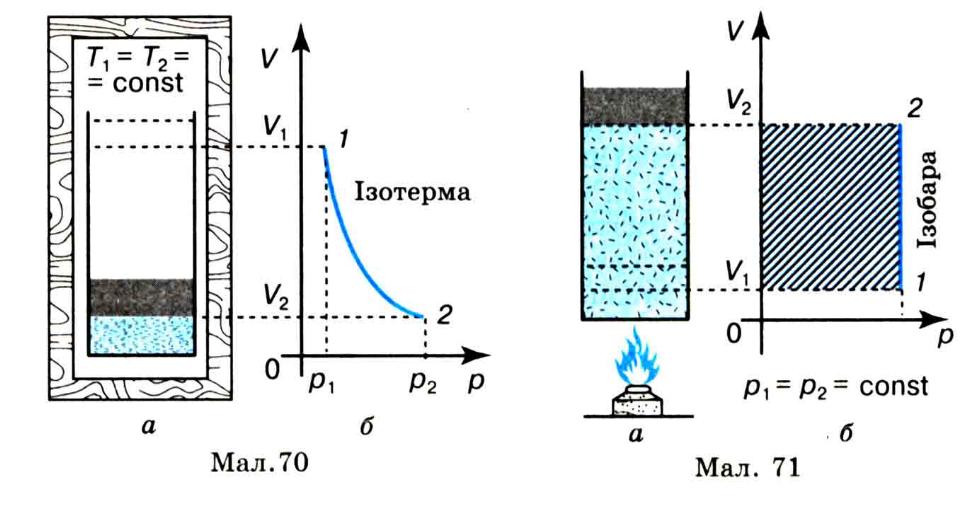
Явище нагрівання газу при його швидкому стисканні можна спостерігати на досліді з приладом «Повітряне кресало» (мал. 72). На дно товстостінного скляного циліндра з поршнем кладуть невеликий шматок піроксилінової вати або вати, змоченої ефіром, і швидко натискують на поршень. Вата спалахує. Причина її загоряння — різке підвищення температури повітря під час швидкого стискання його поршнем.
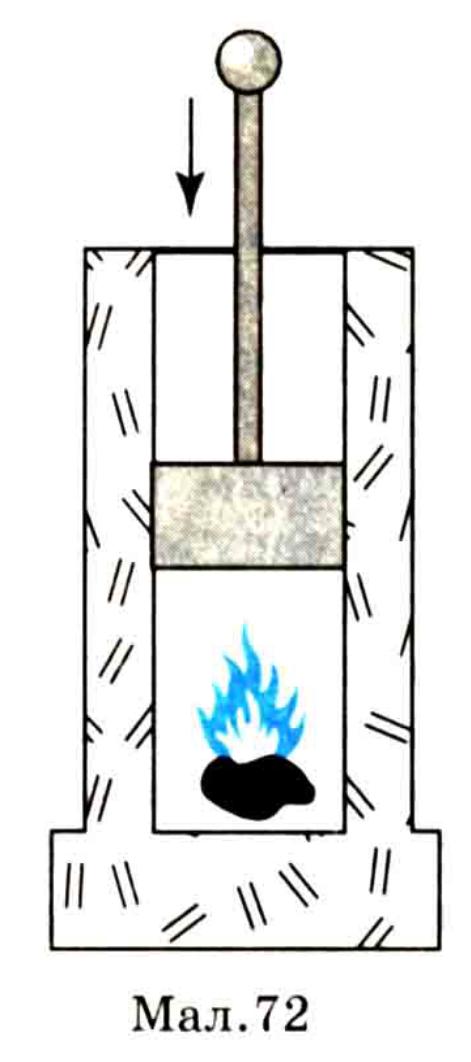
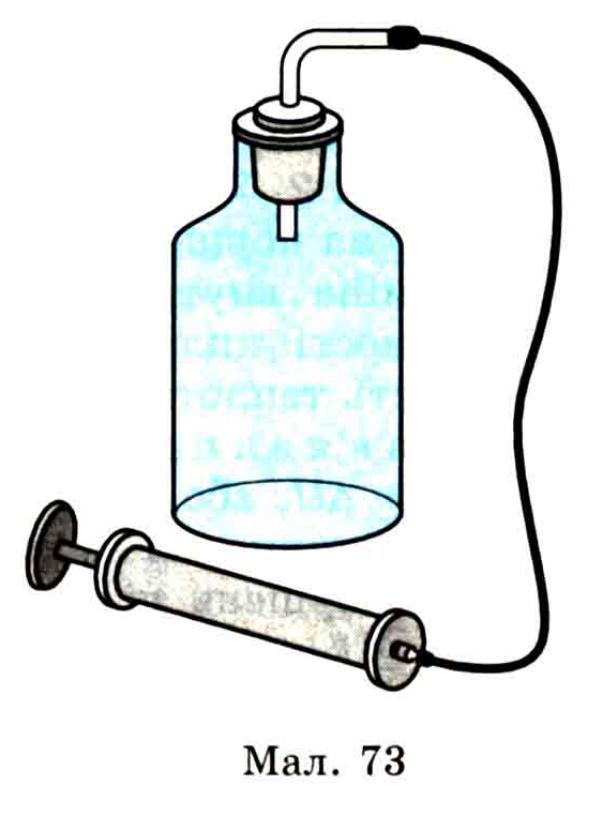
Отже, у разі стискання газу його внутрішня енергія зростає за рахунок роботи зовнішньої сили, яка виконує стискання. При розширенні ж газу без підведення до нього енергії ззовні його внутрішня енергія зменшується. Це можна виявити на такому досліді. У велику скляну посудину (мал. 73) наливають трохи води, вводять дим і накачують повітря. При цьому вода з посудини зникає (випаровується), що свідчить про підвищення температури повітря в посудині. Коли тиск у посудині стане достатньо великим, корок викидається, повітря, швидко розширюючись, виходить з неї, внаслідок чого утворюється густий туман, що свідчить про охолодження повітря під час розширення. Розширюючись, газ виконує роботу з переміщення частинок за рахунок зменшення внутрішньої енергії.
 У
розглянутих прикладах теплообміном
між газом і навколишнім середовищем
можна знехтувати, оскільки зміна його
стану відбувається дуже швидко.
У
розглянутих прикладах теплообміном
між газом і навколишнім середовищем
можна знехтувати, оскільки зміна його
стану відбувається дуже швидко.
Отже, під час стискання газу без теплообміну з навколишнім середовищем його внутрішня енергія збільшується, під час розширення — зменшується. Цей висновок випливає з першого закону термодинаміки:Q = U + A.
Оскільки теплообмін відсутній, Q = 0 і, отже,
U = -A
Це означає, що у разі розширення газу виконується додатна робота за рахунок внутрішньої енергії і це приводить до охолодження газу. Під час стискання газу виконується від’ємна робота, внутрішня енергія газу зростає, він нагрівається.
Процес зміни стану газу, який відбувається без теплообміну з навколишніми тілами, називають адіабатним.
Повністю усунути теплообмін газу з навколишніми тілами неможливо, оскільки в природі не існує речовин, зовсім позбавлених теплопровідності. Але можна стиснути чи розширити газ так, щоб теплообмін був незначним і ним можна було знехтувати. Тому за малий інтервал часу можна вважати Q = 0 і розглядати ці процеси як адіабатні.
Нагрівання повітря від швидкого стискання використовується в дизельних двигунах для запалювання пальної суміші. В циліндри цих двигунів засмоктується атмосферні повітря (а не пальна суміш, як у двигунах внутрішнього згоряння). Від швидкого стискання температура повітря підвищується і до кінця стискання перевищує температуру запалювання пального. В цей момент у циліндр за допомогою спеціальної форсунки вприскують пальне, яке дрібно розпилюється; під час зіткнення з розжареним повітрям воно загоряється.
Коли працюють потужні компресори, які стискають повітря, температура повітря настільки підвищується, що доводиться вдаватися до спеціальної системи охолодження циліндрів.
Охолодження газу під час адіабатного розширення відбувається у величезних масштабах в атмосфері Землі. Нагріте повітря піднімається вгору і розширюється, оскільки атмосферний тиск зменшується з висотою. Це розширення супроводжується значним охолодженням. У результаті пара конденсується і утворюються хмари
Застосування першого закону термодинаміки до процесів зміни стану ідеального газу узагальнено в таблиці 5..