
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ЯДЕРНЫЙ УНИВЕРСИТЕТ «МИФИ» ОБНИНСКИЙ ИНСТИТУТ АТОМНОЙ ЭНЕРГЕТИКИ (ИАТЭ)
ИНЖЕНЕРНО-ФИЗИЧЕСКИЙ ИНСТИТУТ БИОМЕДИЦИНЫ (ИФИБ)
Медицинский факультет Кафедра микробиологии, вирусологии, иммунологии

Гепатит с аутоиммунным механизмом передачи
Реферат по дисциплине
«Иммунология»
Студент 6 курса ЛД1А-С13 группы
Аракелян Татевик Дерениковны
Преподаватель: к.м.н; доцент. зав.кав.
Колесникова Светлана Геннадиевна
Обнинск, 2018 г.
План
|
Введение…………………………………………………… |
3 |
|
Эпидемиология…………………………………………… |
4 |
|
Этиопатогенез…………………………………………….. |
5 |
|
Клиника……………………………………………………. |
10 |
|
Диагностика………………………………………………. |
15 |
|
Особенности течения…………………………………….. |
20 |
|
Лечение…………………………………………………….. |
23 |
|
Список литературы………………………………………. |
26 |
Гепатит с аутоиммунным механизмом передачи. Введение
Аутоиммунные заболевания печени представляют серьезную проблему внутренней медицины с точки зрения как диагностики, так и современной тактики лечения, что сопряжено с обеспечением достойного качества жизни этой категории пациентов. Аутоиммунный гепатит (АИГ) – хроническое аутоиммунное некротически-воспалительное заболевание печени неизвестной этиологии, которое характеризуется перипортальным или более обширным воспалительным процессом в печени, наличием гипергаммаглобулинемии и появлением широкого спектра аутоантител, при котором главной мишенью иммунного ответа является гепатоцит.
Впервые АИГ в качестве отдельной нозологической единицы был описан в начале 50-х годов. В 1956 году Дж. Маккей с коллегами в журнале Lancet описывают заболевание печени у пациентов, в сыворотке крови которых определялись волчаночные клетки, поэтому обозначают эти проявления как люпоидный гепатит. В последующем его стали называть аутоиммунным активным хроническим гепатитом. В 1993 году Международная группа по изучению болезней печени предложила термин аутоиммунный гепатит, а также критерии установления его диагноза.
Эпидемиология
Заболеваемость АИГ в европейских странах составляет 0,1–1,9 случая на 100000 населения в год, а распространенность – от 5 до 20 больных на 100000 жителей. Наиболее редко АИГ встречается в Японии – 0,01–0,08 случая на 100000 населения. В азиатских и африканских странах заболеваемость ниже, что обусловлено, помимо значительной распространенности вирусных гепатитов, отсутствием данных крупных статистических исследований.
АИГ чаще встречается у женщин (85–90 %), в основном в двух возрастных категориях – 10–30 и 50–70 лет, что обусловлено пиками подъема заболеваемости – периодом полового созревания и периодом менопаузы.
Этиопатогенез
К сожалению, единая теория этиопатогенеза АИГ до сих пор отсутствует. Среди триггеров развития аутоиммунных процессов выделяют генетические факторы; вирусы гепатита А, В, С, D, простого герпеса 1 типа, Эпштейна–Барра, ветряной оспы; бактериальные инфекции, сальмонеллезный антиген, дрожжеподобные грибы; лекарственные препараты (прямое токсическое воздействие лекарств или их метаболитов, идиосинкразия к ним, проявляющаяся метаболическими или иммунологическими нарушениями); гормональные факторы и токсины. Важное место в развитии АИГ играет сочетанное действие вышеуказанных факторов.
АИГ чаще развивается у носителей антигенов главного комплекса гистосовместимости HLA-A1, -B8, DR4, C4AQ0 и других, участвующих в иммунорегуляторных процессах. Существенную роль в развитии АИГ играет «аутоиммунный регулятор 1-го типа».
Ключевая роль в патогенезе АИГ принадлежит дефекту иммунорегуляции, проявляющемуся в потере толерантности к собственным антигенам. Под воздействием разрешающих факторов это приводит к появлению «запрещенных» клонов лимфоцитов, сенсибилизированных к аутоантигенам печени и осуществляющих повреждение гепатоцитов.
Имеются две большие системы иммунной защиты. Первая из них – врожденная, естественная или неспецифическая иммунная система, вторая – приобретенная, адаптированная или специфическая иммунная система. Обе эти системы могут в рамках иммунной защиты приводить к разрушению собственных тканей и развитию фиброза.
В физиологических условиях антигены накапливаются в лимфатической ткани с помощью специализированных дендритных клеток – антиген-представляющих клеток (АПК), мигрирующих из других тканей. Дендритные клетки, активированные антигенами, мигрируют вдоль синусоидов в лимфатические капилляры перипортальных трактов, а затем – в лимфатические узлы ворот печени. Далее дендритные клетки дают стимулы недифференцированным Т-клеткам (Тх0, лиганды для рецепторов CD28), превращая их в иммунобласты. Активируясь, лимфоцит дифференцируется, экспрессируя на своей поверхности молекулы адгезии, позволяющие ему избирательно инфильтрировать ткань, участвовавшую в его активации, т.е. печень (хоминг). Длительное сохранение в печени антигена способствует «сенсибилизации» инфильтрирующими лимфоцитами, что неизбежно приводит к развитию воспаления. Экспрессия многочисленных цитокинов запускает непрерывное рекрутирование и задержку лейкоцитов в печени. При удалении антигена из печени сигнал к активации лимфоцитов исчезает, и в результате межклеточных реакций снижается активность воспаления. Наступает фаза покоя – лимфоциты возвращаются в системный кровоток, где сохраняются в течение длительного времени как Т-клетки памяти. Позже хоминг-молекулы, экспрессированные на их поверхности, позволяют Т-клеткам вновь элиминировать антигены печени. В синусоидах содержатся лимфоциты, которые распределяются в печеночных дольках, выполняя лишь функцию контроля (рис. 1).
В основе возникновения аутоиммунных нарушений лежат так называемая антигенная мимикрия и стимуляция поликлональными активаторами аутореактивных В-лимфоцитов. Феномен антигенной мимикрии характерен для инвазивных микроорганизмов, имеющих общие антигенные детерминанты с хозяином, что может вызвать выработку перекрестно реагирующих аутоантител.
На клеточной мембране с помощью молекул HLA (МНС классов I, II) в лимфатическом узле происходит представление пептида антигена дендритной клетке – АПК. Происходит контакт с недифференцированными Т-хелперными клетками (Тх0, недифференцированные клетки), в результате чего Тх0-клетки активируются и дифференцируются или в Тх1-, или в Тх2-клетки. Имеющиеся Т-клетки на своей поверхности экспрессируют множественные молекулы адгезии, образование которых может индуцироваться воспалением. Молекулы адгезии обеспечивают попадание клеток в печень (хоминг), после чего реакция развивается по двум направлениям. Тх2-клетки начинают продуцировать интерлейкины ИЛ-4, ИЛ-5 и ИЛ-10, превращающие В-клетки в плазматические. Плазматические клетки вырабатывают аутоантитела (иммуноглобулины IgG, IgM, IgA) и активируют натуральные киллеры (НК).
ИЛ-2 и ИФН-γ продуцируют Тх1-лимфоциты, стимулирующие цитотоксические Т-лимфоциты (Тц), индуцирующие в АПК синтез протеинов HLA класса I (МНС класса I), а в эндотелии желчных протоков – синтез протеинов HLA класса I и II (МНС класса II) и их экспрессию на мембране гепатоцитов или эндотелия желчных протоков. Экспрессия комплексов HLA повышает уязвимость гепатоцитов, так как к ним проникают цитотоксические CD8- лимфоциты (опосредованно антиген-представляющего HLA класса II). К Т-хелперным клеткам относятся CD4-клетки, которые в зависимости от спектра синтезируемых интерлейкинов делятся на Тх1- и Тх2-клетки. Синтезируемые Тх1-клетками ИЛ-2 и ИФНактивируют макрофаги, которые в свою очередь вырабатывают ИЛ-1 и ФНО-α.
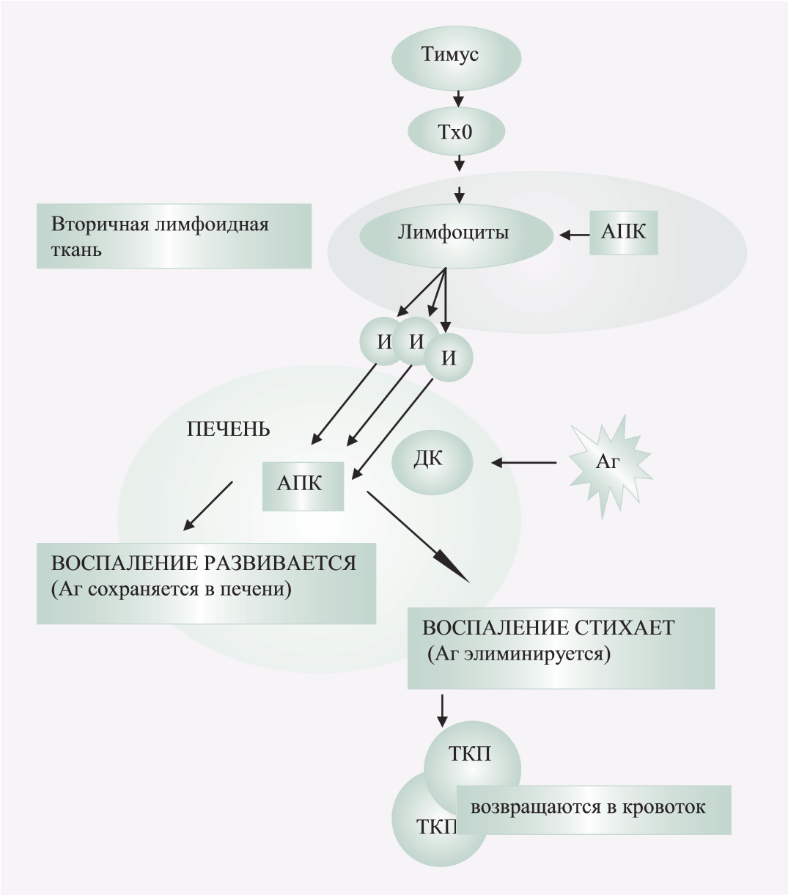
Рис. 1. Схематическое изображение иммунных реакций при аутоимунном гепатите
Аг – антигены; АПК – антиген-представляющие клетки; ДК – дендритные клетки; И – иммунобласты; Тх0 – недифференцированные Т-клетки; ТКП – Т-клетки памяти.
Представление антигена на клеточной поверхности АПК вызывает весь комплекс воспалительных реакций. Предшествуют этому две внутриклеточные реакции: 1) экзогенный антигенпроцессинг и 2) конъюгации антигена с протеином HLA класса II и β2-микроглобулином в тримолекулярный комплекс, который затем размещается в антиген-представляющей «борозде» или «кармане» молекулы HLA «атакующим» лимфоцитом как HLAантиген. Действующие как антигены и образующиеся из структур самой клетки эндогенные пептиды распадаются аналогичным образом до фрагментов из 8 или 9 аминокислот (эндогенный антиген-процессинг) и экспрессируются в «борозде» протеинов HLA класса I как HLA-антиген класса I.
Соединение активированной Т-клетки с АПК эндотелиальной клеткой желчных протоков или гепатоцитами ведет к выделению цитотоксических веществ, вызывающих гибель клетки.
Генетический фактор также играет не последнюю роль в патогенезе АИГ. Локус D хромосомы 6, находящейся в ядре клеткимишени, активирует интерлейкины СD4-клетки, что ведет к синтезу протеинов HLA класса II и дальнейшему повышению уязвимости АПК. Подобно протекает процесс с участием CD8-лимфоцитов, присоединяющихся к домену α3 антигенов HLA класса I, что активирует локусы А, В и С хромосомы 6 и вызывает повышенный синтез HLA класса I и экспрессии антигена HLA класса I (после соединения с антигеном). Описанный механизм, по-видимому, может стимулироваться экзогенным интерфероном, чем можно объяснить развитие у некоторых больных, леченных интерфероном по поводу гепатитов В и С, аутоиммунного гепатита.
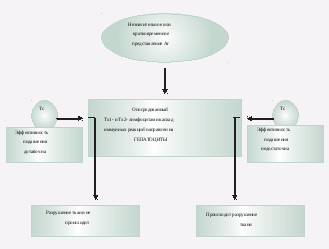
Рис. 2. Результаты кратковременного действия антигенов при аутоимунном гепатите
Аг – антиген; Тс – супрессорный Т-лимфоцит; Тх1, Тх2 – дифференцированные клетки СD4- лимфоцитов.
Исследования последних лет показали, что экспрессируемые Тх1-лимфоцитами ИЛ-2, ИФН-γ и ФНО-α отвечают за активацию и прогрессирование аутоиммунного заболевания печени (т.е. действуют провоспалительно), тогда как ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10 обнаруживаются и при обострении заболевания, и в фазу ремиссии. Это значит, что последние могут обладать противовоспалительными и регуляторными свойствами, а также способностью вызывать дифференцировку В-клеток. Кроме того, следует отметить важную роль в фиброгенезе (репаративных процессах) трансформирующего фактора роста ТФР-β.
Комплекс аутоиммунных реакций при кратковременном и незначительном воздействии антигена подавляется супрессорными Т-лимфоцитами (Тс). При отсутствии подавления указанного механизма наступает разрушение ткани (рис. 2) посредством апоптоза.
