
- •1.Ферменты. Биологическая роль. Структурно-функциональная организация. Активный центр, его участки. Кофакторы и апоферменты. Понятие об энзимопатиях. Энзимотерапия.
- •3.Глюкокортикоиды. Химическая природа, образование, ткани-мишени. Влияние глюкокортикоидов на углеводный, белковый и липидный обмены.
- •1.Различие и сходство неорганических и органических катализаторов. Механизм ферментативного катализа.
- •2.Переваривание белков в двенадцатиперстной кишке. Протеазы поджелудочной железы и энтероцитов: механизм активации, химизм действия, продукты переваривания. Механизм всасывания аминокислот.
- •3.Гормоны щитовидной железы. Химическая природа, образование, ткани-мишени. Регуляция тироксином обмена веществ.
- •1.Регуляция активности ферментов. Направления, уровни регуляции, биологическое значение. Механизмы регуляции: ковалентная модификация структуры, аллостерическая регуляция.
- •3.Кровь. Клеточные и неклеточные компоненты, их биологическая роль.
- •1.Механизмы конкурентного и неконкурентного ингибирования ферментов. Значение для токсикологии. Лекарственные препараты как ингибиторы ферментов.
- •2.Дезаминирование аминокислот. Реакции прямого и непрямого окислительного дезаминирования, ферменты, механизм, продукты реакций. Пути превращений альфа-кетокислот на примере пирувата.
- •3.Плазма крови, химический состав. Неорганические вещества. Биологическая роль. Диагностическое значение определения в плазме крови концентрации натрия, калия, кальция, фосфора, железа.
- •1.Номенклатура и классификация ферментов, связь с видом катализируемой реакции. Понятие об изоферментах, их биологическая роль. Энзимодиагностика.
- •3.Буферные системы тканей и крови. Роль в поддержании кислотно-основного равновесия в организме.
- •1.Белки, уровни структурной организации. Типы связей, стабилизирующих структуру белковой молекулы. Понятие о нативной конформации. Биологическая роль белков.
- •3.Белки плазмы крови. Альбумин, глобулины. Место синтеза, биологическая роль. Белки острой фазы воспаления.
- •1.Первичная и вторичная структуры белка. Механизм спирализации и образование складчатости полипептидов. Особенности состава и структуры глобулярных и фибриллярных белков (кератин, коллаген, эластин).
- •1.Третичная и четвертичная структура белка, химические связи их стабилизирующие. Субъединицы и домены. Кооперативное взаимодействие субъединиц, значение для функционирования белков.
- •1.Физико-химические свойства белков (заряд, гидратная оболочка). Факторы, влияющие на заряд и гидратную оболочку. Понятие об электрофорезе и диализе.
1.Номенклатура и классификация ферментов, связь с видом катализируемой реакции. Понятие об изоферментах, их биологическая роль. Энзимодиагностика.
Номенклатура и классификация
2 названия-короткое(рабочие)+систематическое, применяемое для однозначной идентификации фермента
Рабочие названия
суффикс "аза", присоединённый к названию субстрата реакции( уреаза, сахараза, липаза, нуклеаза) или к названию химического превращения определённого субстрата( лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза). Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно.
Классы ферментов
все ферменты разбиты на 6 основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним.
1.Оксидоредуктазы
Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой).
Систематическое наименование ферментов составляют по формуле "донор: акцептороксидоредуктаза", рабочее - субстрат-подкласс оксидоредуктаз.
Дегидрогеназы.
Катализируют реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются коферменты NAD+, NADP+, FAD, FMN. Все ферменты этой группы обладают высокой субстратной специфичностью.
Малат+ NAD+<малатдегидрогеназа>оксалоацетат+ NAD+Н+
Оксидазы
Акцептором электрона служит молекулярный кислород
![]()
Оксигеназы (гидроксилазы) - атом кислорода из молекулы кислорода присоединяется к субстрату
Дофамин+O2 <дофамингидроксилаза>норадреналин
2.Трансферазы
Катализируют перенос функциональных групп от одного соединения к другом
Подразделяют в зависимости от переносимой группы.
Название этих ферментов составляют по формуле "донор: ацетр-транспортируемая группатрансфераза"
Аланин+альфа-кетоглутарат <аланин-альфа-кетоглутарат аминотрансфераза> пируват+глутаминовая к-та
3.Гидролазы
Реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва).
Подразделяют в зависимости от расщепляемой связи.
Наименование ферментов составляют по формуле "субстрат-гидролаза" или прямым присоединением к названию субстрата суффикса "аза", например протеаза, липаза, фосфолипаза, рибо-нуклеаза
4. Лиазы
К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи.
Наименование ферментов "субстрат-отщепляемая или присоединяемая группировка"(фумаратгидратаза-присоединение к фумарату воды с образованием малата)
5. Изомеразы
Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации.
Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют "мутазой
6. Лигазы (синтетазы)
Реакции присоединения друг к другу двух молекул с образованием ковалентной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют лигазами
В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами (цитратсинтаза-образование цитрата из Ацетил-КоА и оксалоацитата)
Изоферменты
Изоферменты – это множественные формы одного и того же фермента
катализируют одну и ту же реакцию, но отличаются по аминокислотному составу и некоторым физико-химическим свойствам (молекулярной массе, электрофоретической подвижности и др.).
Например, фермент лактатдегидрогеназа (ЛДГ) существует в пяти формах: ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5.
ЛДГ катализирует реакцию:
Г люкоза
люкоза
 ЛДГ
4,5
ЛДГ
4,5

 ПВК
молочная кислота +
2 АТФ
ПВК
молочная кислота +
2 АТФ
ЛДГ 1,2

СО2 + Н2О + 38 АТФ
Каждая ткань имеет определенный изоферментный спектр ЛДГ: в сердечной мышце – ЛДГ1,2; в печени, скелетных мышцах – ЛДГ4,5.
В тканях с преимущественно аэробным обменом веществ (сердечная мышца), преобладают формы ЛДГ1,2, которые обеспечивают ткани большим количеством энергии.
В тканях с преимущественно анаэробным обменом веществ (печень, скелетные мышцы) преобладают ЛДГ4,5, что приводит к образованию молочной кислоты и двух молекул АТФ.
Определение уровня активности изоферментов в сыворотке крови имеет важное значение в диагностике заболеваний. например, повышение активности ЛДГ1,2 наблюдается при инфаркте миокарда; ЛДГ4,5 – при заболеваниях печени (гепатит, цирроз).
2.Реакции трансаминирования (написать реакции с участием аланин- и аспартатаминотрансфераз). Биологическая роль реакции трансаминирования. Клинико-диагностическое значение определения АЛТ и АСТ в сыворотке крови.
Трансаминирование - реакция переноса альфа-аминогруппы с аминокислоты на альфа-кетокислоту=новая аминокислота+новая альфа-кетокислота(реакция обратима)
Витамин В6-пиридоксальфосфат(кофермент)-аминотрансферазы(субстратная специфичность)
1.
 (без
формул, только названия,как во второй
реакции!!!)
(без
формул, только названия,как во второй
реакции!!!)
2.
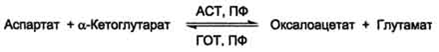
Биологическая роль реакции трансаминирования
Превращение любой аминокислоты в глутамат-далее-окислительное дезаминирование
Путь синтеза заменимых аминокислот, но в этом случае реакция трансиминирования идет в обратном направлении
Трансаминирование связывает между собой белковый и углеводный обмены (из пирувата можно получить глюкозу)
Глюкозо-аланиновый цикл активируется при голодании, когда источниками энергии выступают аминокислоты, а именно аланин мыщц.
<Скелетные мышцы>распад белков <кровь>
аминокислоты(аланин) <печень>трансаминирование
<печень>трансаминирование
пируватглюконеогенезглюкоза<кровь>
(рисунок не надо,он для большей понятности,не более!!!)
Клинико-диагностическое значение
АЛТ и АСТ содержатся только в клетках различных органов и попадают в кровь только при повреждении или разрушении клеток. Повышенный уровень АЛТ и АСТ указывает на наличие заболевания того или иного органа(печень,сердце,меньше-скелетные мышцы)
АСТ-сердечная мышца, АЛТ-печень
