
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1.Витамины, расворимые в жирах:
- •2.Витамины, расворимые в воде:
- •1. Реакции анаэробного гликолиза
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекулбелков
- •5. Растворимость белков
4. Соотношение полярных и неполярных групп на поверхности нативных молекулбелков
На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.
5. Растворимость белков
Растворимость белков в воде зависит от всех перечисленных выше свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
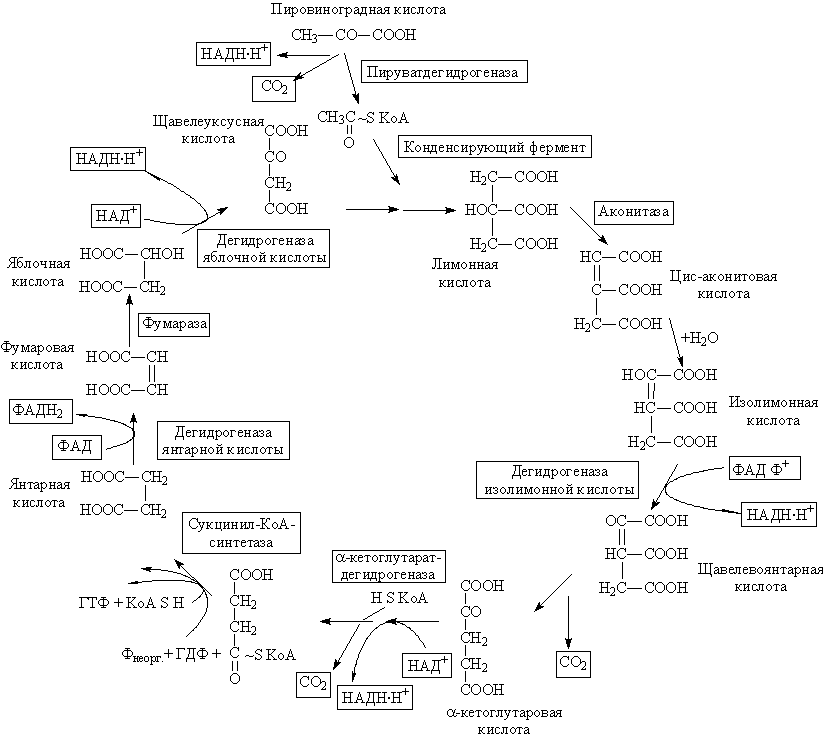
Ц Цикл трикарбоновых кислот (цикл лимонной кислоты или цикл Кребса). Реакции и ферменты цикла.
ТРИКАРБОНОВЫХ КИСЛОТ ЦИКЛ – цикл лимонной кислоты или цикл Кребса – широко представленный в организмах животных, растений и микробов путь окислительных превращений ди- и трикарбоновых кислот, образующихся в качестве промежуточных продуктов при распаде и синтезе белков, жиров и углеводов. Открыт Х.Кребсом и У.Джонсоном (1937). Этот цикл является основой метаболизма и выполняет две важных функции – снабжения организма энергией и интеграции всех главных метаболических потоков, как катаболических (биорасщепление), так и анаболических (биосинтез).
Ч Четвертичная структура белков. Олигомерные белки. Гемоглобин.
Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура.
Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью. Олигомерные белки содержат от 2(гексокиназа) до 312(пируватдегидрогеназа)протомеров. Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностью протомеров.
Комплементарность- пространственное и химическое соответствие взаимодействующих поверхностей.
В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер.
Для белков с четвертичной структурой характерно понятие субъединицы.
Субъединица – это функционально активная часть молекулы белка.
Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 α и 2 β - цепей.
Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия.
Активные центры возникают при образовании четвертичной структуры.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Молекула гемоглобина состоит из четырех отдельных полипептидных цепей двух разных типов: из двух а-цепей и двух бета-цепей. Цепи эти по своему строению напоминают полипептидную цепь миоглобина. Две α цепи содержат по 141 аминокислотному остатку, а две β -цепи — по 146 остатков. Полную структуру гемоглобина определили Кендрью и Перуц. Как и у других глобулярных белков, гидрофобные боковые цепи гемоглобина скрыты внутри молекулы, а гидрофильные выставлены наружу, что делает гемоглобин растворимым в воде. Мутация, вызывающая замену одной из гидрофильных аминокислот на гидрофобную и тем самым снижающая растворимость гемоглобина, служит причиной болезни, известной как серповидноклеточная анемия. Некоторые вирусы, например вирус табачной мозаики, имеют белковую оболочку, состоящую из многих полипептидных цепей, упакованных высокоупорядоченным образом.
