
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1.Витамины, расворимые в жирах:
- •2.Витамины, расворимые в воде:
- •1. Реакции анаэробного гликолиза
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекулбелков
- •5. Растворимость белков
1. Реакции анаэробного гликолиза
При анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза . Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О. Строение лактатдегидрогеназы, механизм действия и значение определения активности этого фермента для диагностики заболеваний описывались ранее в разделе 2.
Баланс АТФ при анаэробном гликолизе
Анаэробный гликолиз по сравнению с аэробным менее эффективен. В этом процессе катаболизм 1 моль глюкозы без участия митохондриальной дыхательной цепи сопровождается синтезом 2 моль АТФ и 2 моль лактата. АТФ образуется за счёт 2 реакций субстратного фосфорилирования. Поскольку глюкоза распадается на 2 фосфотриозы, то с учётом стехиометри-ческого коэффициента, равного 2, количество моль синтезированного АТФ равно 4. Учитывая 2 моль АТФ, использованных на первом этапе гликолиза, получаем конечный энергетический эффект процесса, равный 2 моль АТФ. Таким образом, 10 цитозольньгх ферментов, катализирующих превращение глюкозы в пируват, вместе с лактатдегидрогеназой обеспечивают в анаэробном гликолизе синтез 2 моль АТФ (на 1 моль глюкозы) без участия кислорода.
Д Денатурация и ренатурация белков.
Под денатурациейподразумевают утрату трехмерной конформации, присущей данной белковой молекуле. Это изменение может носить временный или постоянный характер, но и в том и в другом случае аминокислотная последовательность белка остается неизменной. При денатурации молекула развертывается и теряет способность выполнять свою обычную биологическую функцию. Вызывать денатурацию белков могут следующие разнообразные факторы.
Нагревание или воздействие каких-либо излучений, например инфракрасного или ультрафиолетового. Кинетическая энергия, сообщаемая белку, вызывает сильную вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются. Белок свертывается (коагулирует).
Сильные кислоты, сильные щелочи и концентрированные растворы солей. Ионные связи разрываются, и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей.
Тяжелые металлы. Катионы образуют прочные связи с карбоксил-анионами и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок.
Органические растворители и детергенты. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
Ренатурация
Иногда денатурированный белок в подходящих условиях вновь спонтанно приобретает свою нативную структуру. Этот процесс называетсяренатурацией. Ренатурация убедительно показывает, что третичная структура белка полностью определяется его первичной структурой и что сборка биологических объектов может осуществляться на основе немногих общих принципов.
Ж Жирорастворимые витамины D и Е, их химическая природа и физиологическое действие.
Витамин D (кальциферол, антирахитический)
Строение
Витамин представлен двумя формами – эргокальциферол и холекальциферол. Химически эргокальциферол отличается от холекальциферола наличием в молекуле двойной связи между С22 и С23 и метильной группой при С24.
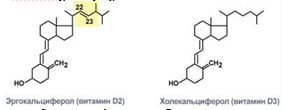
Строение двух форм витамина D
После всасывания в кишечнике или после синтеза в коже витамин попадает в печень. Здесь он гидроксилируется по С25 и кальциферолтранспортным белком переносится к почкам, где еще раз гидроксилируется, уже по С1. Образуется 1,25-дигидроксихолекальциферол или кальцитриол.
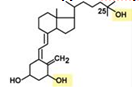
Строение кальцитриола
Реакция гидроксилирования в почках стимулируется паратгормоном, пролактином, соматотропным гормоном и подавляется высокими концентрациями фосфатов и кальция.
Биохимические функции
1. Увеличение концентрации кальция и фосфатов в плазме крови.
Для этого кальцитриол:
- стимулирует всасывание ионов Ca2+ и фосфат-ионов в тонком кишечнике (главная функция),
- стимулирует реабсорбцию ионов Ca2+ и фосфат-ионов в проксимальных почечных канальцах.
2. В костной ткани роль витамина D двояка:
- стимулирует выход ионов Ca2+ из костной ткани, так как способствует дифференцировке моноцитов и макрофагов в остеокласты и снижению синтеза коллагена I типа остеобластами,
- повышает минерализацию костного матрикса, так как увеличивает производство лимонной кислоты, образующей здесь нерастворимые соли с кальцием.
3. Участие в реакциях иммунитета, в частности в стимуляции легочных макрофагов и в выработке ими азотсодержащих свободных радикалов, губительных, в том числе, для микобактерий туберкулеза.
4. Подавляет секрецию паратиреоидного гормона через повышение концентрации кальция в крови, но усиливает его эффект на реабсорбцию кальция в почках.
Витамин Е (токоферол, антистерильный)
Строение
Молекула токоферола состоит из кольца производного бензохинона и изопреноидной боковой цепи. Другие формы витамина E включают иные производные токола, характеризующиеся биологической активностью.
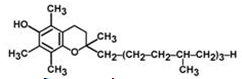
Строение α-токоферола
Биохимические функции
Витамин, встраиваясь в фосфолипидный бислой мембран, выполняет антиоксидантную функцию, т.е. препятствует развитию перекисного окисления липидов. При этом:
1. Лимитирует свободнорадикальные реакции в быстроделящихся клетках – слизистые оболочки, эпителий, клетки эмбриона. Этот эффект лежит в основе положительного действия витамина в регуляции репродуктивной функции у мужчин и у женщин (греч. tokos – потомство, phero – несу).
2. Защищает витамин А от окисления, что способствует проявлению ростстимулирующей активности витамина А.
3. Защищает жирнокислотные остатки мембранных фосфолипидов и, следовательно, любые клеточные мембраны от перекисного окисления.
З Значение и общий энергетический баланс полного окисления (гидролиза) глюкозы.
Определим теперь выход химической энергии в форме АТР при окислении глюкозы в животных клетках до СО2 и H2O.
Гликолитическое расщепление одной молекулы глюкозы в аэробных условиях дает две молекулы пирувата, две молекулы NADH и две молекулы АТР (весь этот пропесс протекает в цитозоле):

Затем две пары электронов от двух молекул цитозольного NADH, образовавшихся в процессе гликолиза под действием глицеральдегидфосфатдегидрогеназы, переносятся в митохондрии при помощи малат-аспартатной челночной системы. Здесь они поступают в цепь переноса электронов и направляются через ряд последовательных переносчиков на кислород. Этот процесс дает 2*3=6ATP поскольку окисление двух молекул NADH описывается следующим уравнением:
![]()
(Конечно, если вместо малат-аспартатной челночной системы действует глицеролфосфатная, то на каждую молекулу NADH образуются не три, а только две молекулы АТР.)
Теперь мы можем написать полное уравнение окисления двух молекул пирувата с образованием двух молекул ацетил-СоА и двух молекул СО2 в митохондриях. В результате этого окисления образуются две молекулы NADH. которые передают затем два своих электрона через дыхательную цепь на кислород, что сопровождается синтезом трех молекул АТР на каждую пару перенесенных электронов:
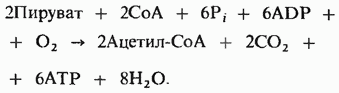
Напишем также уравнение для окисления двух молекул ацетил-СоА до СО2 и H2O через цикл лимонной кислоты и для окислительного фосфорилирования, сопряженного с переносом на кислород электронов, отщепляемых от изоцитрата, α -кетоглутарата и малата: при этом на каждую пару перенесенных электронов образуются по три молекулы АТР. Добавим к этому две молекулы АТР, образующиеся при окислении сукцината, и еще две, которые образуются из сукцинил-СоА через GTP:
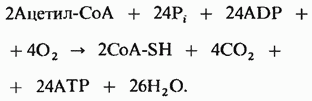
Если теперь просуммировать эти четыре уравнения и сократить общие члены, то мы получим суммарное уравнение для гликолиза и дыхания:
![]()
Итак, на каждую молекулу глюкозы, претерпевающую полное окисление до СО2 и H2O в печени, почках или миокарде, т. е. там, где функционирует малат-аспартатная челночная система, образуется максимум 38 молекул АТР. (Если вместо малат-аспартатной системы действует глицеролфосфатная, то на каждую полностью окисленную молекулу глюкозы образуется 36 молекул АТР.) Теоретический выход свободной энергии при полном окислении глюкозы равен, таким образом, равен 40 % в стандартных условиях (1,0 М).
И Изменение метаболизма при мышечной работе.
Уменьшение концентрации АТФ смещает равновесие креатинфосфокиназной реакции вправо: используется креатинфосфат. Далее включается гликолиз, так системе окислительного фосфорилирования необходима 1 мин для запуска. Это пусковая фаза мышечной работы.
Дальше изменения метаболизма зависят от интенсивности мышечной работы:
1. если мышечная работа длительная и небольшой интенсивности, то в дальнейшем клетка получает энергию путем окислительного фосфорилирования - это работа в "аэробной зоне";
2.если мышечная работа субмаксимальной интенсивности, то - дополнительно к окислительному фосфорилированию включается гликолиз - это наиболее тяжелая мышечная работа - возникает "кислородная задолженность", это - работа "в смешанной зоне";
3.если мышечная работа максимальной интенсивности, но непродолжительная, то механизм окислительного фосфорилирования не успевает включаться. Работа идет исключительно за счет гликолиза. После окончания максимальной нагрузки лактат поступает из крови в печень, где идут реакции глюконеогенеза, или лактат превращается в пируват, который дальше окисляется в митохондриях (ГДФ-путь). Для окисления пирувата нужен кислород, поэтому после мышечной работы максимальной и субмаксимальной интенсивности потребление кслорода мышечными клетками повышено - возвращается кислородная задолженность (долг).
Таким образом, энергетическое обеспечение разных видов мышечной работы различно. Поэтому существует специализация мышц, причем обеспечение энергией у разных мышечных клеток принципиально различается: есть "красные" мышцы и "белые" мышцы.
Красные мышцы - "медленные" оксидативные мышцы. Они имеют хорошее кровоснабжение, много митохондрий, высокая активность ферментов окислительного фосфорилирования. Предназначены для работы в аэробном режиме. Например, такие мышцы служат для поддержания тела в определенном положении (позы, осанка).
Белые мышцы - "быстрые", гликолитические. В них много гликогена, у них слабое кровоснабжение, высока активность ферментов гликолиза, креатинфосфокиназы, миокиназы. Они обеспечивают работу максимальной мощности, но кратковременную.
У человека нет специализированных мышц, но есть специализированные волокна: в мышцах-разгибателях больше "белых" волокон, в мышцах спины больше "красных" волокон.
Существует наследственная предрасположенность к мышечной работе - у одних людей больше "быстрых" мышечных волокон - им рекомендуется заниматься теми видами спорта, где мышечная работа максимальной интенсивности, но кратковременная (тяжелая атлетика, бег на короткие дистанции и тому подобное). Люди, в мышцах которых больше "красных" ("медленных") мышечных волокон, наибольших успехов добиваются в тех видах спорта, где необходима длительная мышечная работа средней интенсивности, например, марафонский бег (дистанция 40 км). Для определения пригодности человека к определенному типу мышечных нагрузок используется пункционная биопсия мышц.
В результате скоростных тренировок (bodybuilding) утолщаются миофибриллы, кровоснабжение возрастает, но непропорционально увеличению массы мышечных волокон, количество актина и миозина возрастает, увеличивается активность ферментов гликолиза и креатинфосфокиназы.
Более полезны для организма тренировки "на выносливость". При этом мышечная масса не увеличивается, но увеличивается количество миоглобина, митохондрий и активность ферментов ГБФ-пути.
М Моносахариды. Классификация. Номенклатура. Изомерия. Структура. Физико-химические свойства.
В природе наиболее распространены моносахариды, в молекулах которых содержится пять углеродных атомов (пентозы) или шесть (гексозы). Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных. Например:
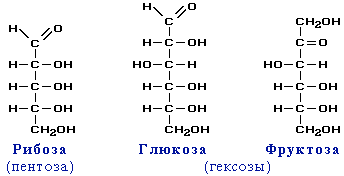
Из этих формул следует, что моносахариды – это полигидроксиальдегиды (альдозы, альдегидоспирты) или полигидроксикетоны (кетозы, кетоноспирты). Рибоза и глюкоза - альдозы (альдопентоза и альдогексоза), фруктоза - кетоза (кетогексоза).
Однако не все свойства моносахаридов согласуются с таким строением. Так, моносахариды не участвуют в некоторых реакциях, типичных для карбонильной группы. Одна из гидроксигрупп отличается повышенной реакционной способностью и ее замещение (например, на группу -OR) приводит к исчезновению свойств альдегида (или кетона).
Следовательно, моносахаридам, кроме приведенных формул, свойственна также иная структура, возникающая в результате внутримолекулярной реакции между карбонильной группой с одним из спиртовых гидроксилов. Известно, что наиболее устойчивыми являются 5-ти и 6-ти членные циклы. Поэтому, как правило, происходит взаимодействие карбонильной группы с гидроксилом при 4-м или 5-м углеродном атоме (нумерация начинается с карбонильного углерода или ближайшего к нему конца цепи).
Таким образом, в результате взаимодействия карбонильной группы с одной из гидроксильных моносахариды могут существовать в двух формах: открытой цепной (оксо-форме) и циклической (полуацетальной). В растворах моносахаридов эти формы находятся в равновесии друг с другом.
Химические свойства моносахаридов обусловлены наличием в молекуле функциональных групп трех видов (карбонила, спиртовых гидроксилов и полуацетального гидроксила). Например, глюкоза как многоатомный спирт образует простые и сложные эфиры, комплексное соединение с гидроксидом меди (II)/NaOH; как альдегид она окисляется аммиачным раствором оксида серебра и гидроксидом меди (II), а также бромной водой, в глюконовую кислоту COOH-(CHOH)4-COOH и восстанавливается водородом в шестиатомный спирт – сорбит CH2OH-(CHOH)4-CH2OH; в полуацетальной формеглюкоза способна к нуклеофильному замещению полуацетального гидроксила на группу -OR (образование гликозидов,олиго- и полисахаридов). Аналогично ведут себя в таких реакциях и другие моносахариды. Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
В живом организме в процессе метаболизма глюкоза окисляется с выделением большого количества энергии:
C6H12O6 +
6O2 ![]() 6CO2 +
6H2O
+ 2920 кДж
6CO2 +
6H2O
+ 2920 кДж
М Механизм действия ферментов. Фермент-субстратный комплекс. Нуклеофильный тип катализа.
После установления химической природы фермента было подтверждено представление Михаэлиса и Ментен о том, что при энзиматическом катализе фермент соединяется с субстратом (они подходят как ключ к замку), образуя нестойкий промежуточный фермент-субстратный комплекс, который в конце реакции распадается с освобождением фермента и продукта реакции.
Даниэль Кошланд предложил теорию «индуцированного» соответствия: т. е. что субстрат навязывает активному центру свою форму, а активный центр в свою очередь подгоняет форму субстрата под свою собственную.
Выдвинутая в 1913 году Л. Михаэлисом и М. Ментен общая теория ферментативного катализа постулировала, что фермент Е сначала обратимо и относительно быстро связывается с со своим субстратом S в реакции:
E + S == ES
Образовавшийся при этом фермент-субстратный комплекс ES, не имеющий аналогий в органической химии и химическом катализе, затем распадается в второй более медленной (лимитирующей) стадии реакции:
ES == Е + Р
1 этап: происходит сближение и ориентация субстрата относительно субстратного центра фермента и его постепенное «причаливание» к «якорной» площадке.
2 этап: напряжение и деформация: индуцированное соответствие - происходит присоединение субстрата, которое вызывает конформационные изменения в молекуле фермента приводящие к напряжению структуры активного центра и деформации связанного субстрата.
3 этап: непосредственный катализ.
В основе химических реакций лежит образование и разрыв химических связей.
Все химические реакции сопровождаются, как правило, разрывом или образованием ковалентных связей. По характеру разрыва ковалентных связей различают три типа реакций.
1. Гетеролитический разрыв связи: ковалентная связь разрывается таким образом, что электронная пара остается с одним из атомов, образующим связь. Атом при этом приобретает отрицательный заряд, а у второго атома возникает положительный заряд. Такие реакции называют также ионными. Гетеролитически разрываются полярные или легкополяризующиеся ковалентные связи. Реакция катализируется кислотами или основаниями;
2. Гомолитический разрыв связи: при разрыве ковалентной связи электронная пара разделяется между атомами с образованием свободных радикалов. Свободные радикалы - это атомы или группы атомов с неспаренным валентным электроном.
Согласованные реакции отличаются от 1 и 2 тем, что разрыв старых связей и образование новых происходит одновременно без образования радикалов или ионов.
Нуклеофильные реагенты: богатые электронами соединения: а) отрицательно заряженные ионы, б) нейтральные молекулы, имеющие свободную неподеленную пару электронов, в) реагенты, способные давать карбанионы в ходе реакций. Нуклеофилы реагируют с органическими субстратами по их положительному реакционному центру. Легко образуют ковалентные связи. Биологически важными нуклеофилами являются аминогруппы, гидроксильные группы, имидазольные группы и сульфгидрильные группы аминокислот. Нуклеофильные формы этих групп одновременно являются основаниями. Связываясь с Н+,- они основания, реагируя с другими электрондефицитными центрами – они нуклеофилы.
Электрофильные реагенты : Электрондефицитные соединения: а) положительно заряженные ионы; б) нейтральные молекулы с частично положительным зарядом на одном из атомов. Электрофилы реагируют с органическими субстратами по их отрицательному реакционному центру. Легко образуют ковалентные связи. Наиболее известными электрофилами в биохимических реакциях являются Н+, ионы металлов, углерод карбонильной группы.
Группы радикалов аминокислот – плохие электрофилы.
По числу молекул реакции можно разделить на мономолекулярные и бимолекулярные. В биологических системах реакции с большим числом участвующих молекул практически не встречаются.
М Механизм сокращения мышц. Модель "весельной лодки".
Сокращение мышечных волокон обусловлено продольным скольжением толстых миозиновых и тонких актиновых филаментов относительно друг друга. Сокращение мышечных волокон является результатом следующего цикла реакций:
1. В отсутствие АТФ (АТР), т. е. в исходном состоянии, головки молекул миозина прочно связаны с актиновыми нитями. При связывании АТФ головки отделяются от актиновых нитей.
2. АТФ-аза головок миозина гидролизует АТФ на АДФ и неорганический фосфат, но продолжает удерживать оба продукта реакции близко друг от друга. Гидролиз АТФ вызывает аллостерические изменения в миозиновой головке.
3. Теперь головка миозина образует новый мостик с соседней молекулой актина.
4. Актин ускоряет выброс продуктов АТФ-азной реакции из активного центра миозина. Это приводит к преобразованию аллостерического напряжения и изменению конформации головки миозина, которое действует подобно «удару весла» (модель весельной лодки). Во время этого «гребка» миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового филамента по направлению к Z-диску. Цикл повторяется до тех пор, пока имеется АТФ.
Каждый «гребок» 500 миозиновых головок толстого филамента вызывает смещение на 10 нм. Во время сильных сокращений частота «гребков» составляет примерно 5 раз в секунду. При каждом цикле гидролиза АТФ головки миозина взаимодействуют с новыми молекулами актина, за счет чего и происходит взаимное скольжение миозиновых и актиновых филаментов, т. е. сокращение мышечного волокна.
М Механизмы энергообеспечения мышечных тканей.
Источники энергии следующие.
Специальные реакции субстратного фосфорилирования.
Гликолиз, гликогенолиз.
Окислительное фосфорилирование.
Специальные реакции субстратного фосфорилирования. Участие специальных реакций субстратного фосфорилирования в обеспечении энергией мышечной клетки различна - это зависит от интенсивности, продолжительности, мощности и длительности мышечной работы.
Креатинфосфокиназная реакция.
Это самый быстрый способ ресинтеза АТФ. Запасов креатинфосфата хватает для обеспечения мышечной работы в течение 20 с.
Максимально эффективен. Не требует присутствия кислорода, не дает побочных нежелательных продуктов, включается мгновенно. Его недостаток - малый резерв субстрата (хватает только на 20 с работы). Обратная реакция может протекать в митохондриях с использованием АТФ, образовавшейся в процессе окислительного фосфорилирования.
Мембрана митохондрий хорошо проницаема как для креатина, так и для креатин-фосфата, а креатинфосфокиназа есть и в саркоплазме, и в межмембранном пространстве митохондрий.
Миокиназная реакция. Протекает только в мышечной ткани!
АДФ --------> АТФ + АМФ.
Реакция катализируется миокиназой (аденилаткиназой).
Главное значение этой реакции заключается в образовании АМФ - мощного аллостерического активатора ключевых ферментов гликолиза, гликогенолиза, ГБФ-пути.
Гликолиз, гликогенолиз.
Не требуют присутствия кислорода (анаэробные процессы). Обладают большим резервом субстратов. Используется гликоген мышц (2 % от веса мышцы) и глюкоза крови, полученная из гликогена печени.
Недостатки следующеи.
Небольшая эффективность: 3 АТФ на один глюкозный остаток гликогена.
Накопление недоокисленных продуктов (лактат).
Гликолиз начинается не сразу - только через 10-15 с после начала мышечной работы.
Окислительное фосфорилирование.
Преимущества.
Это наиболее энергетически выгодный процесс - синтезируется 38 молекул АТФ при окислении одной молекулы глюкозы.
Имеет самый большой резерв субстратов: может использоваться глюкоза, гликоген, глицерин, кетоновые тела.
Продукты распада (CO2 и H2O) практически безвредны.
Недостаток: требует повышенных количеств кислорода.
Важную роль в обеспечении мышечной клетки кислородом играет миоглобин, у которого сродство к кислороду больше, чем у гемоглобина: при парциальном давлении кислорода, равном 30 мм.рт.ст., миоглобин насыщается кислородом на 100 %, а гемоглобин - всего на 30 %. Поэтому миоглобин эффективно отнимает у гемоглобин доставляемый им кислород.
Н Номенклатура и классификация ферментов.
Номенклатура ферментов. На первых этапах развития энзимологии названия ферментам давали их первооткрыватели по случайным признакам (тривиальная номенклатура). Например, к тривиальным относятся названия ферментов: пепсин, трипсин, химотрипсин. Первая попытка ввести правило для названий ферментов была предпринята Е. Дюкло в 1898 г. (рациональная номенклатура). Согласно рациональной номенклатуре, простой фермент называли по названию субстрата с добавлением окончания -аза (ДНКаза, РНКаза, амилаза, уреаза). Для названия холофермента по рациональной номенклатуре использовали название кофермента (пиридоксальфермент, геминфермент). Позднее в названии фермента стали использовать название субстрата и тип катализируемой реакции (алкогольдегидрогеназа).
В 1961 г. V Международный биохимичекий конгресс, проходивший в Москве, утвердил научную номенклатуру ферментов. Согласно этой номенклатуре название фермента складывается из химического названия субстрата (субстратов), на который действует фермент, типа катализируемой реакции и окончания -аза. Например, фермент, осуществляющий гидролиз мочевины (рациональное название - уреаза), по научной номенклатуре называют карбамидамидогидролазой:
![]()
Если в химической реакции участвуют донор какой-либо группировки атомов и акцептор, то фермент называют следующим образом: химическое название донора, химическое название акцептора, тип катализируемой реакции. Например, фермент, катализирующий процесс переаминирования глутаминовой и пировиноградной кислот, называется глутамат: пируватаминотрансфераза.
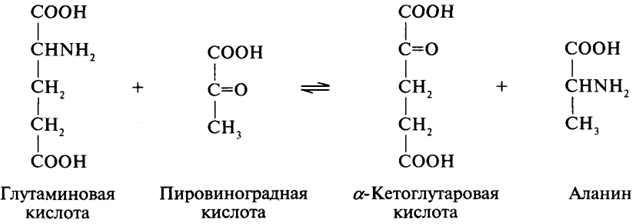
Однако следует отметить, что наряду с названиями по научной номенклатуре допускается использование тривиальных названий ферментов.
Классификация ферментов. В настоящее время известно более 2000 ферментов. Все ферменты разделены на шесть классов, каждый из которых имеет строго определенный номер.
Оксидоредуктазы катализируют окислительно-восстановительные процессы.
Трансферазы катализируют реакции переноса функциональных групп и молекулярных остатков с одной молекулы на другую.
Гидролазы катализируют реакции гидролиза.
Лиазы катализируют реакции отщепления (кроме атомов водорода) с образованием двойной связи либо присоединения по двойной связи, а также негидролитический распад органических соединений либо синтез без участия макроэргических веществ.
Изомеразы катализируют процессы изменения геометрической или пространственной конфигурации молекул.
Лигазы катализируют реакции синтеза, сопровождающиеся гидролизом богатой энергией связи (как правило, АТФ).
Классы ферментов делятся на подклассы, а подклассы, в свою очередь, на подподклассы. Подкласс уточняет действие фермента, так как указывает в общих чертах на природу химической группы субстрата. Подподкласс еще более конкретизирует действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора, который участвует в реакции.
Система классификации предусматривает для каждого фермента специальный шифр, состоящий из четырех кодовых чисел, разделенных точками. Первая цифра в шифре обозначает номер класса, вторая - номер подкласса, третья - подподкласса и четвертая - порядковый номер в данном подподклассе.
О Общее значение и энергетический баланс цикла трикарбоновых кислот.
Цикл трикарбоновых кислот (цикл лимонной кислоты, цикл Кребса) – аэробный метаболический цикл, в котором ацетил–КоА (ключевой метаболит обмена углеводов, белков, жиров) окисляется до СО2 с образованием атомов водорода, которые используются в дыхательной цепи митохондрий для получения АТФ в процессе окислительного фосфорилирования.
1. Образование цитрата (лимонной кислоты) происходит при взаимодействии ацетил-КоА с оксалоацетатом и идет при участии цитратсинтазы.
2.Превращение цитрата в изоцитрат катализируется ферментом аконитазой и состоит из двух этапов. Вначале происходит дегидратация лимонной кислоты с образованием цисаконитовой кислоты, а потом к цис-аконитовой кислоте вновь присоединяется молекула воды с образованием уже изолимонной кислоты.
3.Окисление изоцитрата до α -кетоглутарата происходит при участии НАД-зависимой изоцитратдегидрогеназы, которая является регуляторным ферментом, положительным модулятором которого является АТФ, отрицательным – НАДН2. Образовавшийся НАДН2 далее окисляется в дыхательной цепи митохондрий с генерацией 3 молекул АТФ. В митохондриях имеется еще и НАДФ-зависимая изоцитратдегидрогеназа, так что при окислении изоцитрата образуется не только НАДН2 а и НАДФН2.
4.Окисление α-кетоглутарата до сукцинил-КоА происходит путем окислительного декарбоксилирования при участии мультиэнзимного α-кетоглутаратного комплекса, который подобен пируватдегидрогеназному комплексу. В результате образуется сукцинил-КоА и НАДН2 (последний окисляется в дыхательной цепи с генерацией 3 молекул АТФ).
5. Деацилирование сукцинил-КоА идет под влиянием сукцинил-тиокиназы. За счет энергии расщепления макроэргической тиоэфирной связи сукцинил-КоА образуется ГТФ (гуанозинтрифосфат) макроэргическое соединение, подобное АТФ. Далее ГТФ в нуклеозидфосфокиназной реакции способен превратится в АТФ.
6.Окисление сукцината в фумарат происходит при участии ФАД-зависимой сукцинатдегидрогеназы. Образовавшийся ФАДН2 окисляется в дыхательной цепи с генерацией 2 молекул АТФ.
7.Превращение фумаровой кислоты в яблочную (малат) осуществляется под влиянием фермента фумаратгидратазы.
8.Окисление малата до оксалоацетата (щавелевоуксусной кислоты) происходит под влиянием НАД-зависимой малатдегидрогеназы. Образовавшийся НАДН2 окисляется в дыхательной цепи с генерацией 3 молекул АТФ. В митохондриях имеется еще и НАДФ-зависимая малатдегидрогеназа, которая продуцирует НАДФН2. Оксалоацетат - конечный продукт ЦТК может вступить во взаимодействие с новыми молекулами ацетил-КоА.
Энергетический баланс ЦТК. В ЦТК образуется 2 молекулы СО2 (в изоцитратдегидрогеназной и α-кетоглутаратдегидрогеназной реакциях) и 3 молекулы НАДН2 и одна молекула ФАДН2. Окисление НАДН2 в дыхательной цепи митохондрий дает по 3 молекулы АТФ на каждую молекулу НАДН2 и по 2 молекулы АТФ на каждую молекулу ФАДН2. Одна молекула АТФ образуется за счет субстратного фосфорилирования на этапе превращении сукцинил-КоА в сукцинат. Таким образом, при полном окислении 1 молекулы ацетил-КоА до СО2 и Н2О генерируется 12 молекул АТФ.
ЦТК регулируется через изменение активности аллостерических ферментов цитратсинтетазы; изоцитратдегидрогеназы; альфа–кетоглутаратдегидрогеназы. Они активируются АДФ, но ингибируются АТФ, НАДН2, сукцинил–КоА, длинноцепочечными ацил–КоА.
Значение ЦТК.
1.Интегративное – цикл Кребса объединяет пути катаболизма углево-
дов, белков и жиров, т.к. в нем утилизируется молекулы ацетил-КоА, образующиеся при расщеплении этих веществ.
2.Энергетическое. При расщеплении 1 молекулы ацетил-КоА до конечных продуктов
(СО2 и Н2О) генерируется 12 молекул АТФ.
3.Амфиболическое (двойственное). В ЦТК происходит не только катаболические процессы – окисление ацетил-КоА. Субстраты ЦТК используются и для реакций синтеза (анаболические процессы). Так, из оксалоацетата синтезируется аспарагиновая кислота; из α-кетоглутаровой кислоты – глутаминовая; из оксалоацетата - фосфоэнолпируват.
4.Гидрогендонорное. Реакции дегидрирования происходящие в ЦТК служат источником атомов водорода (НАДН2) для дыхательной цепи. В ЦТК образуется и НАДФН2 (НАДФ-зависимые изоцитрат- и малатдегидрогеназы), который далее используется как восстановитель при синтезе жирных кислот, стероидных гормонов, окислении ксенобиотиков.
О Олигосахариды. Классификация. Дисахариды: состав, структура и биологические функции на примере мальтозы, сахарозы и лактозы.
Дисахариды состоят из двух остатков моносахаридов, соединенных между собой О-гликозидной связью. Если один полуацетальный гидроксил остается свободным, а дисахариды проявляют альдегидные свойства, то такие дисахариды называются восстанавливающими. Если же связь между двумя остатками моносахаридов осуществляется посредством обоих полуацетальных гидроксилов, то для таких дисахаридов альдегидные свойства не характерны и они называются невосстанавливающими.
Для дисахаридов первого типа сохраняется возможность кольчато-цепной таутомерии и способность к мутаротации.
Для невосстанавливающих дисахаридов эти явления не характерны.
Восстанавливающие дисахариды часто называют гликозо-гликозидами, а невосстанавливающие – гликозидо-гликозидами.
Связи С–О–С в межмономерном узле изображаются изогнутыми линиями. Если же необходимо изобразить дисахариды, которые связаны гликозид-гликозидной связью («голова к голове») как в молекуле трегалозы, то первая молекула пишется обычным образом, а вторая получается из нее поворотом на 180º в плоскости оксидного кольца.
Для восстанавливающих дисахаридов, название начинается с невосстанавливающего звена, которое рассматривают как заместитель в восстанавливающем. Звено восстанавливающего моносахарида составляет коренное слово. Между названиями моносахаридных звеньев ставят в скобках цифры, указывающие номера атомов углерода этих звеньев, связанных через кислород. Цифры соединяют запятой или стрелкой, направленной от углеродного атома, являющегося гликозидным центром. Таким образом, название мальтозы в соответствии с номенклатурой будет α-D-глюкопиранозил[1→4]-D-глюкопираноза, а лактозы – β-D-галактопиранозил[1→4]-D-глюкопираноза.
В случае невосстанавливающих дисахаридов название одного из мономерных моносахаридов входит в общее название с суффиксом “ил”, а другого – с суффиксом “ид”. Если в состав дисахарида входят два одинаковых остатка моносахаридов, то не имеет значения, какой из них будет назван первым. Примером такого дисахарида является трегалоза, систематическое название которой будет α-D-глюкопиранозил-α-D-глюкопиранозид.
Если же в состав дисахарида входят остатки двух разных моносахаридов, то начинать название можно с любого из них.
В этом случае традиционное название сахарозы будет α-D-глюкопиранозил-β-D-фруктофуранозид (но не β-D-фруктофуранозил-α-D-глюкопиранозид).
Дисахариды, как и моносахариды, представляют собой кристаллические вещества, хорошо растворимые в воде, плохо – в спирте и практически нерастворимы в неполярных органических растворителях.
Гидролиз дисахаридов протекает достаточно легко в связи с тем, что связь между моносахаридными звеньями ацетальная.
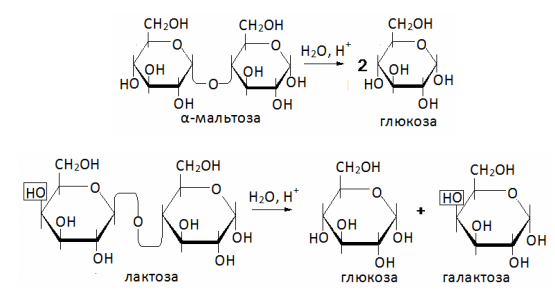
Окисление
Как уже отмечалось ранее, для восстанавливающих дисахаридов в качестве окислителей можно использовать реактив Толленса, Фелинга, бром и другие вещества, окисляющие альдегиды.
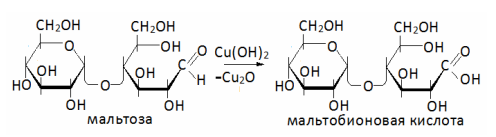
Восстанавливающие дисахариды обычно кристаллизуются из тех же растворителей, что и моносахариды, и, как правило, в виде определенного аномера. Они проявляют свойства, присущие карбонильной группе в моносахаридах.
Различия химических свойств дисахаридов и моносахаридов обусловлены наличием в молекулах первых лабильной гликозидной связи.
Невосстанавливающие дисахариды по своему химическому поведению имеют сходства, например, алкил- или арилгликозидами. Так, полуацетальная группировка в них блокирована, и карбонильная функция не проявляется.
П Пептидная связь. Структура и свойства пептидной связи. Пептиды. Состав и структура пептидов. Номенклатура. Пептиды небелковой природы и их биологическая роль.
Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, окгапептид и т.д.
Пептиды, содержащие более 10 аминокислот, называют "полипептиды", а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин "белок" часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном.
Мономеры аминокислот, входящих в состав белков, называют "аминокислотные остатки". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную ?-карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название "пептидный остов.
При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил, за исключением С-концевой аминокислоты.
Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом.
Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот.
![]()
.Характеристика пептидной связи
Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу.
Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки.
В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein - белок, lysis - разрушение), называемых также протеазами, или пептидгидролазами.
Биологическая роль пептидов
В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью.
Открытые и изученные в настоящее время пептиды можно разделить на группы по их основному физиологическому действию:
- пептиды, обладающие гормональной активностью (окситоцин, вазопрессин, рилизинг-гормоны гипоталамуса, меланоцитстимулирующий гормон, глюкагон и др.);
пептиды, регулирующие процессы пищеварения (гастрин, холецистокинин, вазоинтестиналшый пептид, желудочный ингибирующий пептид и др.);
пептиды, регулирующие тонус сосудов и АД (брадикинин, калидин, ангиотензин II);
пептиды, регулирующие аппетит (лептин, нейропептид Y, меланоцитстимулирующий гормон, (?-эндорфины);
пептиды, обладающие обезболивающим действием (энкефалины и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
пептиды, участвующие в регуляции высшей нервной деятельности, в биохимических процессах, связанных с механизмами сна, обучения, памяти, возникновения чувства страха и т.д.
П Полисахариды. Состав, структура, классификация. Важнейшие представители (целлюлоза и крахмал), их биологическое значение.
Полисахариды – это углеводы, состоящие из большого числа мономерных звеньев, которые соединены между собой гликозидными связями. Они являются высокомолекулярными соединениями, построенными по принципу поликонденсации. Нередко полисахариды имеют в своем составезаместители неуглеводной природы – остатки серной, фосфорной или органических кислот.
Молекулярные массы полисахаридов лежат в пределах от нескольких тысяч (ламинарин, инулин) до нескольких миллионов (гиалуроновая кислота, гликоген). Как правило, молекулярные массы могут быть определены лишь ориентировочно в связи с тем, что индивидуальные полисахариды обычно являются смесями компонентов, различающихся степенью полимеризации.
Первые названия полисахаридов связаны с источником их получения: крахмал, целлюлоза, амилопектин, хинин и др. В настоящее время их названия составляются заменой окончания «оза» в названии исходного моносахарида на «ан». А полисахаридытакже называют гликанами.
Все полисахариды делятся на два больших класса:
1. Гомополисахариды построены из остатков только одного вида моносахаридов. Среди них в зависимости от названия моносахарида, являющегося мономерной единицей, различают глюканы, маннаны, галактаны, ксиланы и т. д.
2. Гетерополисахариды построены из остатков двух и более различных моносахаридов. Иногда для гетерополисахаридов, построенных из двух типов мономеров, названия составляют смешением имен исходных моносахаридов. Например, продуктом конденсации арабинозы и галактозы будут арабиногалактаны, глюкозыи маннозы – глюкоманнаны и т. д.
Однако любой образец полисахарида в строгом смысле слова не гомогенен, а представляет собой смесь полимергомологов.
В природе полисахариды составляют главную массу органического вещества биосферы. Они выполняют в живых организмах важнейшие функции: структурные полисахариды придают клеточным стенкам прочность, водорастворимые полисахариды не дают клеткам высохнуть, резервные полисахариды по мере необходимости расщепляются на моносахариды и используются организмом, выступая в роли энергетического резерва.
Хорошо известными резервными полисахаридами являются крахмал, гликоген, фруктаны, галактоманнаныи др. Они способны быстро гидролизоваться имеющимися в клетках ферментами.
Структурные полисахариды можно разделить на два класса. К первому относят нерастворимые в воде полимеры, образующие волокнистые структуры и служащие армирующим материалом клеточной стенки (целлюлоза высших растений и некоторых водорослей, хитин грибов). Ко второму классу относят гелеобразующие полисахариды, обеспечивающие эластичность клеточных стенок и адгезию клеток в тканях. Характерными представителями этого класса полисахаридов являются гликозаминогликаны (мукополисахариды) соединительной ткани животных, пектины и некоторые гемицеллюлозы высших растений.
К защитным полисахаридам относят камеди высших растений (гетерополисахариды сложного состава и строения), образующиеся в ответ на повреждение растительной ткани, и внеклеточные полисахариды микроорганизмов и водорослей, образующие защитный слой или изменяющие свойства среды обитания клеток.
Полисахариды обычно построены из остатков альдоз. Гликозидные связи образуются за счет гидроксила при C(1)-атоме углерода одного моносахаридного остатка и любого другого гидроксила следующего моносахаридного остатка. Полисахариды, мономерные звенья которых соединены гликозидными связями одного типа, образуют длинные линейные цепи. Если же в полисахариде имеются гликозидные связи различных типов или различные остатки моносахаридов, то может возникнуть разветвленная цепь.
Целлюлоза представляет собой полимер бета-глюкозы. В целлюлозе заключено около 50% углерода, находящегося в растениях, и по общей своей массе целлюлоза на Земле занимает первое место среди всех органических соединений. Практически всю целлюлозу поставляют растения, хотя она встречается также у некоторых низших беспозвоночных и у примитивных групп грибов. Такое большое количество целлюлозы на Земле, обусловлено тем, что у всех растений из нее построены клеточные стенки: в среднем 20—40% материала клеточной стенки составляет именно целлюлоза. Строение молекул целлюлозы делает их как нельзя лучше приспособленными для этой роли. Они представляют собой длинные цепи — приблизительно из 10 000 остатков глюкозы. Эти цепи, в которых остатки глюкозы соединены бета-1,4-связями, прямолинейны в отличие от цепей крахмала, альфа-1,4-связи которых делают их способными изгибаться и свертываться. Из каждой такой цепи выступает наружу множество —ОН-групп. Эти группы направлены во все стороны и образуют водородные связи с соседними цепями, что обеспечивает жесткое поперечное сшивание всех цепей. По 60—70 цепей объединены друг с другом в микрофибриллы, а последние в свою очередь собраны в пучки, т. е. в более крупные структуры, называемые макрофибриллами.
Крахмал — полимер альфа-глюкозы. У растений крахмал служит главным запасом «горючего». У животных крахмала нет; в их организме его функцию выполняет гликоге. Крахмал может быть легко снова расщеплен до глюкозы, которая используется в процессе дыхания. В прорастающих семенах из глюкозы синтезируется также целлюлоза и другие необходимые для роста материалы. Молекулы крахмала состоят из двух компонентов — амилозы и амилопектина. В линейных цепях амилозы несколько тысяч остатков глюкозы соединены 1,4-связями, что позволяет им спирально свертываться и принимать более компактную форму. У разветвленного полисахарида амилопектина компактность обеспечивается интенсивным ветвлением цепей за счет образования 1,6-гликозидных связей. Амилопектин содержит приблизительно вдвое больше глюкозных остатков, чем амилоза. С раствором иода в йодистом калии (KI) водная суспензия амилозы дает темно-синюю окраску, а суспензия амилопектина — красно-фиолетовую. На этом основана проба на крахмал. Крахмал запасается в клетках в виде так называемых крахмальных зерен. Их можно видеть в первую очередь в хлоропластах листьев, а также в органах, где запасаются питательные вещества, например в клубнях картофеля или в семенах злаков и бобовых. Крахмальные зерна имеют слоистую структуру и у разных видов растений различаются как по форме, так и по размерам.
П Понятие активного центра ферментов. Структура и функции активного центра.
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется активным центром фермента.
Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
В его пределах различают Адсорбционный участок (центр) и каталитический участок (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином аллостерический центр.
Каталитический центр - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K.
Адсорбционный центр - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит только за счет слабых типов связей и потому является обратимой. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями. Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошленд положил в основу теории индуцированного соответствия (или наведенного соответствия), которая преодолела ограниченность существовавшей ранее теории ключа и замка (жесткого соответствия структуры субстрата структуре адсорбционного центра).
Очевидно, что именно структура адсорбционного центра определяет субстратную специфичность фермента, т. е. требования фермента к молекуле химического вещества, чтобы она могла стать для него подходящим субстратом.
Некоторые вещества, обладающие подходящими характеристиками (т. е. похожие на субстрат), могут тоже связываться с адсорбционным центром фермента. Но если в их молекуле нет такой химической связи, на которую может воздействовать каталитический центр данного фермента, то химических превращений этого вещества не произойдет. Занимая активный центр фермента, такие молекулы блокируют его работу, т. е. являются обратимыми ингибиторами данного фермента (обратимыми, потому что связаны с ферментом слабыми типами связей). Повышая концентрацию субстрата, их можно вытеснить из адсорбционного центра. Поэтому такие ингибиторы называют конкурентными. Они конкурируют с истинным субстратом данного фермента за обладание его адсорбционным центром.
Аллостерическими центрами называют такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит - обратимо) с тем или иным веществом (лигандом). Причем такое связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами или аллостерическими ингибаторами данного фермента.
Термин "аллостерический" (т. е. "имеющий иную пространственную структуру") появился в связи с тем, что эти эффекторы по своей пространственной конфигурации совсем не похожи на молекулу субстрата данного фермента (и потому не могут связываться с активным центром фермента). Было сделано заключение, что и аллостерический центр не похож по своей структуре на активный центр фермента.
Аллостерические центры найдены не у всех ферментов. Они есть у тех ферментов, работа которых может изменяться под действием гормонов, медиаторов и других биологически активных веществ. Некоторые искусственно синтезированные лекарства обладают биологической активностью потому, что их молекулы комплементарны аллостерическому центру некоторых ферментов организма.
П Принципы метаболизма и энергетики. Свободная энергия. Изменение стандартной свободной энергии.
Обмен веществ и энергии — совокупность процессов превращения веществ и энергии, происходящих в живых организмах, и обмен веществами и энергией между организмом и окружающей средой. Обмен веществ и энергии является основой жизнедеятельности организмов и принадлежит к числу важнейших специфических признаков живой материи, отличающих живое от неживого. В обмене веществ, или метаболизме, обеспеченном сложнейшей регуляцией на разных уровнях, участвует множество ферментных систем. В процессе обмена поступившие в организм вещества превращаются в собственные вещества тканей и в конечные продукты, выводящиеся из организма. При этих превращениях освобождается и поглощается энергия.
Для понимания сущности обмена веществ и энергии в живой клетке нужно учитывать ее энергетическое своеобразие. Все части клетки имеют примерно одинаковую температуру, т.е. клетка изотермична. Различные части клетки мало отличаются и по давлению. Это значит, что клетки не способны использовать в качестве источника энергии тепло, т.к. при постоянном давлении работа может совершаться лишь при переходе тепла от более нагретой зоны к менее нагретой. Т.о., живую клетку можно рассматривать как изотермическую химическую машину.
Между обменом веществ и обменом энергии существует одно принципиальное различие. Земля не теряет и не получает сколько-нибудь заметного количества вещества. Вещество в биосфере обменивается по замкнутому циклу и т.о. используется многократно. Обмен энергией осуществляется иначе. Она не циркулирует по замкнутому циклу, а частично рассеивается во внешнее пространство. Поэтому для поддержания жизни на Земле необходим постоянный приток энергии Солнца. За 1 год в процессе фотосинтеза на земном шаре поглощается около 1021 калсолнечной энергии. Хотя она составляет лишь 0,02% всей энергии Солнца, это неизмеримо больше, чем та энергия, которая используется всеми машинами, созданными руками человека. Столь же велико количество участвующего в кругообороте вещества. Так, годовой оборот углерода составляет 33×109 т.
Другим, не менее важным для живых организмов элементом, чем углерод, является азот. Он необходим для синтеза белков и нуклеиновых кислот. Главным резервом азота на Земле служит атмосфера, почти на 4/5 состоящая из молекулярного азота. Однако вследствие химической инертности атмосферного азота большинство живых организмов его не усваивают. Лишь азотфиксирующие бактерии обладают способностью восстанавливать молекулярный азот и таким образом переводить его в связанное состояние. Связанный азот совершает беспрерывный круговорот в природе. Восстановленный азот, попадающий в почву в виде аммиака как продукт обмена веществ животных или образуемый азотфиксирующими бактериями, окисляется почвенными микроорганизмами до нитритов и нитратов, которые попадают из почвы в высшие растения, где восстанавливаются с образованием аминокислот, аммиака и ряда других азотсодержащих продуктов. Эти соединения попадают в организм животных, питающихся растительной пищей, затем в организм хищных животных, поедающих травоядных, и все еще в восстановленной форме возвращаются в ночву, после чего весь цикл повторяется снова.
Валовый (суммарный) обмен вещества и энергии. Законы сохранения вещества и энергии послужили теоретической основой для разработки важнейшего метода исследования обмена веществ и энергии —установления балансов, т.е. определения количества энергии и веществ, поступающих в организм и покидающих его в форме тепла и конечных продуктов обмена. Для определения баланса веществ необходимы достаточно точные химические методы и знание путей, по которым различные вещества выделяются из организма. Известно, что главными пищевыми веществами являются белки, липиды и углеводы. Как правило, для оценки содержания белков в пище и в продуктах распада достаточно определить количество азота, т.к. практически весь азот пищи находится в белках, в т.ч. в нуклеопротеинах; незначительным количеством азота, входящим в состав некоторых липидов и углеводов, в опытах по определению азотистого баланса можно пренебречь. Определение липидов и углеводов в пищевых продуктах требует специфических методов, что же касается конечных продуктов обмена липидов и углеводов, то это почти исключительно СО2 и вода.
Баланс энергии определяют на основании калорийности вводимых пищевых веществ и количества выделенного тепла, которое может быть измерено или рассчитано. При этом надо учитывать, что величина калорийности, получаемая при сжигании веществ в калориметрической бомбе, может отличаться от величины физиологической калорической ценности, т.к. некоторые вещества в организме не сгорают полностью, а образуют конечные продукты обмена, способные к дальнейшему окислению. В первую очередь это относится к белкам, азот которых выделяется из организма главным образом в виде мочевины, сохраняющей некоторый потенциальный запас калорий. Важной величиной, характеризующей особенности обмена отдельных веществ, является дыхательный коэффициент (ДК), который численно равен отношению объема выдыхаемого СО2 к объему поглощенного О2. Калорическая ценность, ДК и величина теплообразования, рассчитанная на 1 л потребленного О2 для разных веществ различны. Физиологическая калорическая ценность (в ккал/г) составляет для углеводов — 4,1; липидов — 9,3; белков — 4,1; величина теплообразования (в ккал на 1 л потребленного О2) для углеводов — 5,05; липидов — 4,69; белков — 4,49.
Промежуточный обмен веществ. Совокупность химических превращений веществ, которые происходят в организме, начиная с момента их поступления в кровь и до момента выделения конечных продуктов обмена из организма, называют промежуточным, или межуточным обменом (промежуточным метаболизмом). Промежуточный обмен может быть разделен на два процесса: катаболизм (диссимиляция) и анаболизм (ассимиляция). Катаболизмом называют ферментативное расщепление сравнительно крупных органических молекул, осуществляемое у высших организмов, как правило, окислительным путем. Катаболизм сопровождается освобождением энергии, заключенной в сложных структурах органических молекул, и запасанием ее в форме энергии фосфатных связей АТФ. Анаболизм представляет собой ферментативный синтез крупномолекулярных клеточных компонентов, таких, как полисахариды, нуклеиновые кислоты, белки, липиды, а также некоторых их биосинтетических предшественников из более простых соединений. Анаболические процессы происходят с потреблением энергии. Катаболизм и анаболизм происходят в клетках одновременно и неразрывно связаны друг с другом. По существу, их следует рассматривать не как два отдельных процесса, а как две стороны одного общего процесса — метаболизма, в котором превращения веществ теснейшим образом переплетены с превращениями энергии.
Свободная энергия (дельтаG), т.е. доступная клетке энергия - это та часть энергии, которая может быть превращена в работу. При протекании химических реакций в живом организме самопроизвольно идут те процессы, в которых изменение свободной энергии будет отрицательным (-дельтаG). Такие процессы называются экзергоническими . Процессы, для которых дельтаG является величиной положительной, называютсяэндергоническими . Эти процессы не могут происходить самопроизвольно. При протекании эндергонических процессов необходим приток энергии извне.
Для каждой химической реакции характерно определенное изменение стандартной свободной энергии (-дельтаG0'), т.е. изменение свободной энергии при стандартных значениях температуры и давления, 1М концентрации исходных веществ и продуктов реакции и рН 7,0. Например, дельтаG0' гидролиза АТФ до АДФ.
П Простые белки: состав, структура, классификация (основные представители).
ПРОСТЫЕ БЕЛКИ – это биополимеры, которые построены из остатков аминокислот, соединенных между собой пептидной связью.
Наука которая изучает строение и функции белков называет протеомикой.
Функции белков. Белки выполняют в организме большинство функций и с ними связаны практически все проявления жизни. Белки делят на такие группы:
1. Каталитические белки. Это специализованный класс белков – ферменты.
2. Сократительные белки. Выполняют функцию движения ( актин и миозин).
3. Защитные белки (антитела, другие антимикробные факторы; защита от кровопотери – фибриноген, факторы свертывания крови т.д.)
4. Регуляторные белки. Сигнальные белки и олигопептиды, гормоны, рецепторы и т.д.
5. Транспортные белки (транспорт веществ в крови, через мембраны). Сейчас известно свыше 6 тысяч транспортных белков.
6. Структурные белки – мембраные, соединительной ткани (коллаген, эластин т.д.), волос (α– кератин) т.д.
7. Пищевые – содержатся в продуктах питания.
8. Запасные и т.д.
Альбумины: обнаружены во многих тканях (главным образом в цитоплазме клеток, в мышцах – миоальбумины; в молоке – лактальбумины; нервная ткань – содержит нейроальбумины, высокое содержание в сыворотке крови – 40-50г/л), имеют сходные свойства. Молекулярная масса – до 70000, это кислые белки, ИЭТ около 4,7, содержат много глутаминовой кислоты, имеют глобулярную структуру, растворимы в воде. Альбумины крови синтезируются в печени, обуславливают онкотическое давление крови (при снижении альбуминов возникают отеки).
Альбумины крови это основные транспортные белки в организме, они обеспечивают транспорт водо- и жирорастворимых витаминов, билирубина, лекарств.
Глобулины – имеют большую массу (выше 150000 Да), плохо растворимы в воде и легче альбуминов, осаждаются солями, электрофорезе глобулины крови разделяются на несколько фракций (α-, β- и γ-глобулины), в которых обнаруживаются такие белки как – протромбин, церуллоплазмин, иммуноглобулины.
Протамины и гистоны: ядерные белки (в ядре клетки связаны с нуклеиновыми кислотами), содержат много аргинина и лизина (гистоны до 30%, а протамины до 60%), которые обуславливают положительный заряд этих белков (катионные белки), ИЭТ в щелочной среде.
Проламины и глутелины – растительного происхождения белки (глутелин – белок пшеницы, зеин – выделен из кукурузы), содержать недостаточные количества незаменимых аминокислот, поэтому в пищевом отношении это неполноценные белки
Пептиды – выделяют несколько груп пептидов ( нейропептиды - эндорфины, энкефалины), пептиды кининовой системы и др.
Простые (однокомпонентные) ферменты – пепсин, трипсин.
Сократительные белки - актин, миозин.
Белковоподобные вещества (склеропротеины)
Белки – наиболее важный компонент живой материи, это – биополимеры, построенные из остатков α-аминокислот, соединенных между собой пептидной (-СО-NH-) связью.
Элементарный состав белков.
а) С (углерод) – 50-55%; О (кислород) – 21-24%; N (азот) – 15-17% (≈ 16%);
Н (водород) – 6-8%; S (сера)– 0-2%.
Азот - это постоянный компонент белков и по его количеству можно определить содержание белка в тканях.
б) содержание белков в органах человека составляет в среднем 18-20% сырой массы ткани. В пересчете на сухой остаток - мышцы – до 80%, сердце – 60%, печень – 72%, легкие , селезенка – 82 – 84%.
В состав белков входят 20 стандартных аминокислот, т.е. аминокислоты, включение которых в молекулу белка кодируется на генетическом уровне.
П Путь распада олиго- и полисахаридов и их ферментативное обеспечение.
Известны три типа ферментативного расщепления глюканов: 1) фосфоролиз, 2) гидролиз и 3) трансгликозилирова-ние.
Фосфоролнз. Превращение крахмала, гликогена и аналогичных полисахаридов в глюкозо-1-фосфат катализируют а-1,4-глюканфосфорилазы (называемые также просто фосфорилазами).Хотя эта реакция обратима, она, видимо, происходит только при внутриклеточном распадеполисахаридов, но не при их синтезе. Фосфоролиз начинается со свободного нередуцирующего конца цепи амилозы, причем при разрыве каждой связи освооождается одна молекула глюкозо-1-фосфата. В молекуле амилопектина фосфоролиз останавливается в точках ветвления (1,6-связи) и может продолжаться только после воздействия амило-1,6-глюкозидазы. Фосфорилазы играют решающую роль при мобилизации накопленных в клетках полисахаридов (глюканов):
Гидролиз. Вне клетки крахмал подвергается гидролитическому расщеплению амилазами. а-Амилаза имеется у растений, животных и многих микроорганизмов. Она очень быстро разжижает крахмал, воздействуя одновременно на многие а-1,4-связи во всех частях молекулы (поэтому ее называют также «эндоамилазой»). Продуктами расщепления оказываются, помимо мальтозы, также олигомеры, содержащие от 3 до 7 остатков глюкозы. Вследствие быстрого разрушения макромоле-кулярной структуры крахмала быстро уменьшается и вязкость раствора, и окрашиваемость иодом; постепенно появляются сбраживаемые сахара (глюкоза, мальтоза, мальтотриоза). Если совместно с ос-амилазой воздействует амило-1,6-глюкозидаза (амилодекстриназа), то расщепляются и декстрины.
-Амилазы встречаются только у растений (ячменя, пшеницы и др.). В отличие от а-амилаз они не воздействуют на внутренние участки молекулы (это только «экзоамилазы»), а расщепляют ее, начиная с нереду-цирующего свободного конца - отделяют мальтозу с редуцирующей группой. При воздействии (3-амилазы крахмал долгое время сохраняет способность окрашиваться иодом, но быстро осахаривается. Гидролиз приостанавливается лишь после того, как будет расщеплена примерно половина амилопектина. Образовавшийся остаток называют ^-концевым декстрином. Если амило-1,6-глюкозидаза со своей стороны обеспечивает разрыв цепей в точках ветвления молекулы, то происходит полное расщепление полисахарида до мальтозы. Мальтоза может ги-дролизоваться вне клетки под действием малыпазы. При наличии соответствующих пермеаз мальтоза и низшие олигомеры поступают в клетку и подвергаются здесь фосфоролитическому расщеплению.
Трансгликозилирование. В содержащих крахмал средах, на которых выращивали Bacillusmacerans, Шардингер обнаружил кристаллические вещества. Оказалось, что это замкнутые в кольцо цепи, состоящие из остатков глюкозы, соединенных ос-1,4-гликозидными связями. Эти а-, (3-или у-циклодекстрины, содержащие по 6, 7 или 8 остатков глюкозы в кольце, образуются из крахмала под действием трансгликозилаз.
Р Регуляция мышечного сокращения.
Электромеханическое сопряжение
Сокращением мышечного волокна управляют двигательные нейроны, которые выделяют нейромедиатор ацетилхолин в нервно-мышечные соединении (синапсы). Ацетилхолиндиффундирует через синаптическую щель и взаимодействуют с ацетилхолиновыми (холинэргическими)рецепторами плазматической мембраны мышечных клеток. Это вызывает открывание трансмембранных ионных каналов и деполяризацию клеточной мембраны (образование потенциала действия). Потенциал действия быстро распространяется по всем направлениям от нервно-мышечного соединения, возбуждая все мышечные клетки. В течение нескольких миллисекунд реализуется рассмотренный выше цикл сокращения мышечного волокна.
Саркоплазматический ретикулум
Саркоплазматический ретикулум [СР (SR)] -разветвленная подобная эндоплазматическому ретикулумуорганелла, окружающая индивидуальные миофибриллы подобно сетке (в верхней части схемы в качестве примера приведен СР клетки сердечной мышцы). В покоящихся клетках концентрация Са2+ очень низка (менее 10-5 М). Однако в саркоплазматическом ретикулуме уровень ионов Са2+ существенно выше (около 10-3 М). Высокая концентрация Са2+ в СР поддерживается Са2+-АТФ-азами. Кроме того, в СР имеется специальный белок кальсеквестрин (55 кДа), который благодаря высокому содержанию кислых аминокислотспособен прочно связывать ионы Са2+.
Переносу потенциала действия на СР индивидуальной миофибриллы способствуют поперечные трубочки Т-системы, представляющие трубчатые впячивания клеточной мембраны и находящиеся в тесном контакте с индивидуальными миофибриллами. Деполяризация плазматической мембраны передается через Т-трубочки на потенциал-управляемый мембранный белок (так называемый "SR-foot") прилегающей мембраны СР, который открывает Са2+-каналы. Результатом является выброс ионов Са2+ из СР в пространство между филаментами актина и миозина до уровня ≥10-5 M. В конечном итоге выброс ионов Са2+ является пусковым механизмом процесса сокращения миофибрилл.
Регуляция ионами кальция
В расслабленной скелетной мышце комплекс тропонина (субъединицы = Т, С, I) с тропомиозиномпрепятствует взаимодействию миозиновых головок с актином.
Быстрое увеличение в цитоплазме концентрации ионов кальция в результате открывания каналов СР приводит к связыванию Са2+ с С-субъединицей тропонина. Последняя по свойствам близка кальмодулину. Связывание ионов Са2+ вызывает конформационную перестройку в тропонине, тропонинтропомиозиновый комплекс разрушается и освобождает на молекуле актина участок связывания смиозином (на схеме выделен красным цветом). Это инициирует цикл мышечного
В отсутствие последующего стимулирования АТФ-зависимые кальциевые насосы мембраны СР быстро снижают концентрацию ионов Ca2+ до исходного уровня. Как следствие, комплекс Са2+ с тропонином С диссоциирует, тропонин восстанавливает исходную конформацию, место связывания миозина на актинеблокируется и мышца расслабляется.
Таким образом, при сокращении мышечного волокна скелетных мышц позвоночных происходит следующая последовательность событий. При поступлении сигнала от двигательного нейрона мембрана мышечнойклетки деполяризуется, сигнал передается на Сa2+-каналы СР. Са2+-каналы открываются, внутриклеточный уровень ионов Са2+ возрастает. Ионы Сa2+ связывается с тропонином С, вызывая конформационную перестройку в тропонине, что влечет за собой разрушение комплекса тропонин-тропомиозин и дает возможность головкам миозина связываться с актином. Происходит инициация актин-миозинового цикла.
По завершении сокращения уровень ионов Са2+ снижается за счет активного обратного транспорта Са2+ в СР, тропонин С отдает Са2+, комплекс тропонин-тропомиозин занимает исходное положение на молекулеактина, блокируя актин-миозиновый цикл. Результатом является расслабление мышцы.
Р Роль и задачи биологической химии. Состав живых организмов. Биомолекулы.
Биологическая химия – это наука, изучающая химический состав живых организмов, превращения веществ и энергии, лежащей в основе их жизнедеятельности. Совокупность этих превращений составляет биологический обмен веществ, который является основой той формы движения материи, которую мы называем жизнью. Объекты живой природы состоят из «неживых» молекул, большинство из которых представляют собой органические соединения. Тем не менее, живые организмы обладают необычными свойствами, отсутствующими в скоплении неживых молекул. К ним относятся следующие свойства:
1.1 Сложность и высокая степень организованности. Живые организмы представлены миллионами разных видов.
1.2 Любая составная часть организма имеет специальное назначение и выполняется строго определенную функцию. Это относится даже к индивидуальным химическим соединениям (липиды, белки и т.п.).
1.3Способность извлекать, преобразовывать и использовать энергию окружающей их среды – либо в форме органических питательных веществ, либо в виде энергии солнечного излучения.
Обмен веществ слагается из множества отдельных химических реакций, протекающих в живом организме и теснейшим образом связанных друг с другом. Данные экспериментальной биохимии свидетельствуют о взаимосвязи и неразрывности процесса поглощения и усвоения питательных веществ – ассимиляции и процесса их разложения и выделения – диссимиляции. Сопряженность и взаимосвязь отдельных реакций, происходящих при ассимиляции и диссимиляции питательных веществ в организме, проявляется также в сопряженности превращений энергии, происходящих в течение всей жизни организма.
1.4 Способность к точному самовоспроизведению.
Цель биохимии состоит в том, чтобы понять, каким образом взаимодействия биомолекул друг с другом порождают описанные выше особенности живого состояния.
Большинство химических компонентов живых организмов представляют собой органические соединения, т.е. соединения углерода, в которых атомы углерода ковалентно связаны с другими атомами углерода, а также с атомами водорода, кислорода и азота. Однако все разнообразие органических молекул в живых организмах сводится к довольно простой картине. Все макромолекулы в клетке состоят из простых и небольших молекул нескольких типов, используемых в качестве строительных блоков, которые связываются в длинные цепи, содержащие от 50 до многих тысяч звеньев (ДНК построена из дезоксирибонуклеотидов, белки – из аминокислот).
В живых организмах широко представлены четыре типа соединений – полимеров, образующих макромолекулы, состоящие из повторяющихся единиц – мономеров. Это белки, нуклеиновые кислоты, углеводы и липиды. Макромолекулы составляют около 90% сухого вещества клеток живых организмов.
Биомолекулы — это органические вещества, которые синтезируются живыми организмами. В состав биомолекул включают белки, полисахариды, нуклеиновые кислоты, а также более мелкие компоненты обмена веществ. Биомолекулы состоят из атомов углерода, водорода, азота, кислорода, а также фосфора и серы. Другие атомы входят в состав биологически значимых веществ значительно реже.
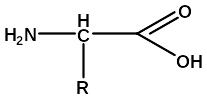
С Свойства аминокислот, входящих в состав белков. Их классификация, стереохимия и кислотно-основные свойства.
Аминокислоты – гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу:
Биологические функции аминокислот
структурные элементы пептидов и белков
предшественники гормонов, коферментов, желчных кислот, антибиотиков
переносчики сигналов – нейромедиаторы и предшественники нейромедиаторов
участники метаболических процессов: доноры азота, метильной группы, метаболиты орнитинового цикла.
аминокислота реакция белок
Стереохимия аминокислот
Природные аминокислоты являютcя 2-аминокарбоновыми кислотами (или б-аминокислотами). У б-aминoкиcлoт при атоме C-2 (Cб) имеются четыре различных зaмecтитeля: каpбокcильнaя группа, аминогруппа, атом водорода и боковая цепь R. Таким образом, все б-аминокислоты, кроме глицина, имеют асимметрический (хиральный) б-углеродный атом и cущeствуют в виде двух энантиомеров (L- и D-aминoкиcлoт). Пpотeиногенныe аминoкиcлoты oтноcятcя к L-ряду. D-Аминoкиcлоты вcтpeчaютcя в бaктepиях, например в сocтaвe муреинов, и в пептидных антибиотиках:
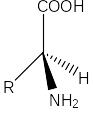
![]()
![]()

L-аминокислота D-аминокислота
Кислотно-основные свойства аминокислот
Все аминокислоты являются амфотерными соединениями. Они содержат, по крайней мере, две противоположные по свойствам группы: кислотную (карбоксильную) и основную (аминогруппу). Обе группы являются слабоионизируемыми и в растворе существуют в двух формах, заряженной и незаряженной, между которыми устанавливается протонное равновесие:
![]()
Суммарный заряд аминокислоты зависит от рН среды. В растворе аминокислоты ВСЕГДА заряжены. Незаряженные формы используются для удобства при написании формул.
Значение pH, при котором суммарный заряд аминокислоты равен нулю и поэтому она не перемещается в электрическом поле, называется ее изоэлектрической точкой (pI).
С Свойства ферментов: специфичность и активность ферментов. Зависимость активности ферментов от температуры (термолабильность) и pH среды.
1.Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа.
2.Зависимость каталитической активности фермента от температуры выражается типичной кривой. Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом. Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. Однако есть ферменты с более высоким температурным оптимумом, например, у папаина (фермент растительного происхождения, ускоряющий гидролиз белка) оптимум находится при 8О°С. В то же время у каталазы (фермент, ускоряющий распад Н2О2 до Н2О и О2) оптимальная температура действия находится между 0 и -10°С, а при более высоких температурах происходит энергичное окисление фермента и его инактивация.
3. Зависимость активности фермента от значения рН среды была установлена свыше 50 лет назад. Активность ферментов – способность в разной степени ускорять скорость реакции. Активность выражают в:
1) Международных единицах активности – (МЕ) количество фермента, катализирующего превращение 1 мкМ субстрата за 1 мин.
2) Каталах (кат) – количество катализатора (фермента), способное превращать 1 моль субстрата за 1 с.
3) Удельной активности – число единиц активности (любых из вышеперечисленных) в исследуемом образце к общей массе белка в этом образце.
4) Реже используют молярную активность – количество молекул субстрата превращенных одной молекулой фермента за минуту.
4. Специфичность - одно из наиболее выдающихся качеств ферментов. Эго свойство их было открыто еще в прошлом столетии, когда было сделано наблюдение, что очень близкие по структуре вещества - пространственные изомеры (a- и b-метилглюкозиды) расщепляются по эфирной связи двумя совершенно разными ферментами.
Различают:
1). Абсолютную – когда фермент катализирует только одну определенную реакцию (аргиназа – расщепление аргинина)
2).Относительную (групповую спец) – фермент катализирует определенный класс реакций (напр. гидролитическое расщепление) или реакции при участии определенного класса веществ.
Специфичность ферментов обусловлена их уникальной аминокислотной последовательностью, от которой зависит конформация активного центра, взаимодействующего с компонентами реакции.Вещество, химическое превращение которого катализируется ферментом носит название субстрат.
5. Влияние на скорость химической реакции: ферменты увеличивают скорость химической реакции, но сами при этом не расходуются.
Ферменты- сложные белки- содержат в своём составе, помимо белкового компонента, ещё и небелковый например, нуклеотиды, гуминовую группу, витамины, атомы ( катионы ) металла. К таким ферментам обычно относятся ферменты окислительно-восстановительного действия. Прочность связи между белковым компонентом и простатической группой в сложных ферментах может быть различной. В некоторых случаях связь прочная, в других - простатическая группа довольно легко отделяется, например при диализе. Легко диссоциирующие простатические группы ферментов получили название коферментов. При отделении простатической группы от белковой части фермента - последний теряет свою активность. В простых ферментах активный центр образуется непосредственно группировкой аминокислотных остатков в спиральной цепи белковой молекулы. В сложных ферментах он образуется простатической группой и некоторыми прилегающими к ней остатками. Размер активных центров значительно меньше самой молекулы фермента. На один активный центр приходится масса молекулы с молекулярным весом 30000. В простых ферментах пространственная группировка этих аминокислотных остатков сама по себе определяет структуру активного уентрацентра и каталитическую активность фермента. В сложных ферментах структура активного центра определяется простатической группой и боковыми группами некоторых аминокислотных остатков, пространственная структура которых оказывает существенное влияние на специфичность и каталитическую активность небелкового компонента. Среди таких аминокислотных остатков наибольшее значение имеют SH- группы цистеина, OH- группы серина, несколько меньшее значение имеет индольная группа триптофана, карбонильные группы дикарбоновых аминокислот. Компоненты активного центра нельзя представлять последовательно расположенными на, каком - либо участке цепи. По- видимому , активный центр формируется из компонентов, удалённых в первичной структуре полипептидной цепи, но пространственно сближенных благодаря специфической укладке полипептидной цепи.
С Сложные белки: состав, структура, классификация (основные представители).
Простые белки построены только из аминокислот. Сложные белки построены из двух компонентов - простой белок и небелковое вещество, называемое простетической группой. Простетические группы прочно связаны с белковой частью молекулы.
Классификация сложных белков зависит от строения простетической группы.
Гликопротеины (содержат углеводы).
Липопротеины (содержат липиды).
Фосфопротеины (содержат фосфорную кислоту).
Хромопротеины (содержат окрашенную простетическую группу).
Металлопротеины (содержат ионы различных металлов).
Нуклеопротеины (содержат нуклеиновые кислоты).
Гликопротеины. Простетические группы этих белков представлены углеводами и их производными.
Гликопротеины содержат от 1 до 30 % углеводов, которые прочно связаны с белковой частью молекулы. Они представлены различными моносахаридами, их ацетил-амино-производными, дезоксисахаридами, нейраминовыми и сиаловыми кислотами. Они могут быть также представлены линейными или разветвленными олигосахаридами.
Функции гликопротеинов:
большинство белков на внешней поверхности животных клеток (рецепторы);
большая часть синтезируемых клеточных белков (интерфероны);
большая часть белков плазмы крови (кроме альбуминов):
иммуноглобулины;
групповые вещества крови;
фибриноген, протромбин;
гаптоглобин, трансферин;
церулоплазмин;
мембранные ферменты;
гормоны (гонадотропин, кортикотропин).
Связь между углеводными компонентами и белковой частью в гликопротеинах ковалентно-гликозидная, через ОН группы серина, треонина, или NH группу лизина, аспарагина, глутамина.
Протеогликаны. Углевод в этих белках составляет основную часть молекулы (до 95 %).Углеводы представлены высокомолекулярными гетерополисахаридами. Их называют гликозаминогликанами - это линейные неразвлетвленные полимеры. Они построены из повторяющихся дисахаридных единиц. Углеводы и белки в молекулах протеогликанов связаны гликозидными связями через гидрокси-группы серина, треонина и NH2-лизина, аспарагина и глутамина.
Молекулы протеогликанов прекрасно гидратируются благодаря большому количеству функциональных ионизированных групп. Этим объясняется их эластичность, растяжимость, слизистый характер. Они способны также связовать ионы Nа+, поэтому они учавствуют в регуляции водно-солевого обмена.
Липопротеины - сложные белки. Их простетическая группа представлена разнообразными липидами. Существует несколько классов липидов. Каждый из них выполняет специфическую биологическую функцию.
Фосфолипиды - большая группа различных по строению омыляемых липидов, являющихся обязательными компонентами биомембран. Их молекулы содержат наряду с углеводородными цепями полярную ионизированную часть. Фосфолипиды не запасаются клеткой. Они постоянно обновляются.
Фосфолипиды делятся на:
глицерофосфолипиды - состоит из фосфатидной кислоты и спирта;
сфингофосфолипиды - второй важный класс мембранных липидов;
гликолипиды - разновидность сфинголипидов.
В них отсутствует фосфорная кислота, но есть углеводный компонент.
Транспортные и плазменные липопротеины. В плазме крови присутствуют свободные липопротеины. Они в отличие от остальных липидов растворимы в воде. Это объясняется строением их комплексов.
Различают 4 класса плазменных липопротеинов:
хиломикроны;
липопротеины очень низкой плотности (ЛПОНП);
липопротеины низкой плотности (ЛПНП);
липопротеины высокой плотности (ЛПВП).
Классификация липопротеинов зависит от их плотности. Плотность - от содержания в них липидов. Чем больше липидов, тем ниже плотность.
Строение плазменных липопротеинов напоминает мицеллу. Ядро их состоит из неполярных гидрофобных липидов. Наружный слой - из полярных частей молекул фосфолипидов и белков. Такое строение обеспечивает растворимость липопротеинов в плазме.
Функции транспортных липопротеинов.
Все липопротеины выполняют транспортную роль. Они переносят экзогенные, всосавшиеся из кишечника триаглицериды и холестерин к жировым депо и печени. От печени, где синтезируются эндогенные фосфолипиды и холестерин, они транспортируются ко всем внутренним органам, где используются. Поэтому липопротеины плазмы называют транспортными формами липидов. Каждый класс липопротеинов транспортирует ту фракцию липидов, которая в нем преобладает.
В стабилизации молекул структурных и свободных липопротеинов участвуют нековалентные силы.
Гидрофобные - между гидрофильными радикалами жирных кислот и гидрофобными радикалами аминокислот.
Ионные - электростатические связи между ионизированными группами молекул аминокислот и фосфолипидов.
Фосфопротеины - сложные белки. Их простетическая группа представлена фосфорной кислотой. Остатки фосфата соединяются с белковой частью молекулы сложноэфирными связями через гидрокси-группы аминокислот серина и треонина.
К фосфопротеинам относятся казеины - белки молока, вителлины - яичного желтка, овальбумин - белок куриного яйца. Большое количество их содержится в ЦНС. Многие важные ферменты клетки активны только в фосфорилированной форме. Фосфопротеины являются источником энергетического и пластического материала.
Металлопротеины кроме белка содержат ионы одного или нескольких металлов. Ионы металлов соединены координационными связями с функциональными группами белка.
Пример металлопротеинов:
ферритин, трансферрин - Fe;
алкогольдегидрогеназа - Zn;
цитохромоксидаза - Cu;
протеиназы - Mg, К;
АТФ-аза - Na, К, Са, Мg.
Как правило, металлопротеины - ферменты. Ионы металлов выполняют следующие функции:
являются активным центром фермента;
служат мостиком между активным центром фермента и субстратом, сближают их;
служат акцепторами электронов на определенной стадии ферментативной реакции.
Обмен нуклеопротеинов.
Нуклеопротеины - это сложные белки, небелковым компонентом которых являются нуклеиновые кислоты - ДНК (дезоксирибонуклеиновая кислота) или РНК (рибонуклеиновая кислота). В живом организме нуклеиновые кислоты находятся в диссоциированном состоянии. В составе белковых компонентов очень много положительно заряженных аминокислот - аргинина и лизина, поэтому их можно отнести к поликатионам (гистоны).
Белковые компоненты подвергаются обмену, как простые белки.
С Строение мышцы. Структура фибрилл (А-, I-диски, саркомеры).
Мышечные волокна построены из продольно расположенных миофибрилл диаметром около 1 мкм, в которых видны чередующиеся темные и светлые диски. Темные диски обладают двойным лучепреломлением и называются А-(анизотропными) дисками; светлые диски, необладающие двойным лучепреломлением, называются I-(изотропными) дисками (рис. 29). В середине диска I расположена плотная линия Z, которая пронизывает все волокно, как бы удерживая миофибриллы в пучке и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Пучок миофибрилл от одной до другой Z-линии называется саркомером. Диски А имеют в середине более светлую полосу - зону Н, пересекаемую более темной М-зоной. В одной миофибрилле может содержаться до 1000 - 1200 саркомеров. Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплазматический ретикулум, составляющий 8 - 10% объема клетки; 3) несколько митохондрий.
![]()
Т Толстые и тонкие филаменты. Субединицы тропонина.
Скелетные поперечнополосатые мышцы позвоночных состоят из параллельных пучков мышечных волокон. Каждое волокно представляет собой одну большую многоядерную клетку. Большую часть объема мышечных клеток занимают миофибриллы толщиной 1-2 мкм, простирающиеся на всю длину мышечного волокна. Поперечная исчерченность, характерная для миофибрилл скелетных мышц, связана с чередованием различных по толщине молекул.
Сократительные элементы, саркомеры, состоят из двух типов параллельных нитей, толстых филаментов миозина и тонких филаментов F-актина . Крайние, более темные области Α-дисков содержат как тонкие, так и толстые нити, тогда как центральная часть, Н-зона, содержит только нити миозина. Z-линии (или Z-пластинки) соответствуют тем участкам, где тонкие нити крепятся к так называемым Z-дискам. Саркомером называется продольная единица, ограниченная двумя Z-линиями.
В количественном отношении наиболее важным белком миофибрилл является миозин (~65% мышечного белка). Молекула миозина построена из шести субъединиц, двух идентичных тяжелых цепей (2 х 223 кДа) и четырех легких цепей (~20 кДа), связанных нековалентно. Каждая тяжелая цепь миозина имеет форму длинного стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (на схеме внизу справа). α-Спиральные участки двух тяжелых цепей свернуты в двойную суперспираль, а четыре небольших субъединицы связаны с глобулярными головками. В мышечном волокне миозин образует толстые миозиновые филаменты, которые представляют собой пучки из сотен молекул миозина, расположенных параллельно. Головка молекулы миозина обладает Са2+-зависимой АТФ-азной активностью, которая регулируется малыми субъединицами.
Главным белком тонких нитей является актин (42 кДа, ~20-25% мышечного белка). Фибриллярный F-актин является важным структурным элементом цитоскелета; он находится в равновесии с глобулярным G-актином.
Кроме этих двух белков система включает тропомиозин и комплекс тропонина. Нитевидный тропомиозин(64 кДа) связан с F-актином, охватывая примерно семь актиновых субъединиц. Тропонин (78 кДа) - комплекс, состоящий из трех различных субъединиц (Т, С, I), способен связываться как с актином, так и с тропомиозином. Остальные белки, присутствующие в гораздо меньшем количестве, включают α- и β-актинин, десмин, коннектин (титин) и виментин.
Т Третичная структура белков и природа сил. стабилизирующих ее. Инсулин и рибонуклеаза А.
Под третичной структурой понимают пространственное расположение полипептидной цепи (способ укладки цепи в определенном объеме). В стабилизации пространственной структуры основную роль играют нековалентные связи. К ним относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот (гидрофобные взаимодействия), диполь-дипольные взаимодействия. Кроме того, важную роль в формировании третичной структуры играют дисульфидные связи (S-S-мостики).
Интересно отметить, что информация для образования третичной структуры содержится в полипептидной цепи, а дисульфидные мостики только закрепляют третичную структуру (инсулин, рибонуклеаза)
Дисульфидные связи образуются при окислении сближенных в пространственной структуре белка остатков цистеина в остатки цистина. Считают, что дисульфидные связи, часто множественные, особенно важны для стабилизации маленьких белков, в которых не может возникнуть обширной системы нековалентных взаимодействий.
Третичная структура – уникальное для каждого белка расположение в пространстве полипептидной цепи, зависящее от количества и чередования аминокислот, т.е. предопределенное первичной структурой белка. Конфигурация белковых молекул может быть фибриллярной и глобулярной. Третичная структура многих белков составляется из нескольких компактных глобул, называемых доменами. Между собой домены обычно бывают связаны тонкими перемычками вытянутыми аморфными полипептидными цепями Кроме того, в белках встречаются мотивы укладки полипептидной цепи, похожие на орнаменты на индейских и греческих вазах: мотив меандра, мотив греческого ключа, мотив зигзага-"молнии".
При свертывании белковой глобулы значительная часть (не менее половины) гидрофобных радикалов аминокислотных остатков оказывается скрытой от контакта с окружающей белок водой. Происходит образование своеобразных внутримолекулярных «гидрофобных ядер». В них особеннопредставлены объемные остатки лейцина, изолейцина, фенилаланина, валина. С появлением третичной структуры у белка появляются новые свойства – биологические. В частности, проявление каталитических свойств связано с наличием у белка третичной структуры. И наоборот, нагревание белков, приводящее к разрушению третичной структуры (денатурация), приводит и к утрате биологических свойств.
Первый белок, у которого была расшифрована первичная структура, — гормон инсулин (1955 г.). Это — простой белок, состоящий из двух полипептидных цепей (одна цепь содержит 21 аминокислотный остаток, другая - 30 остатков), соединенных двумя дисульфидными мостиками . На установление его структуры английскому биохимику Ф. Сангеру потребовалось 10 лет.
Принципиальная возможность синтеза белков была доказана на примере двух гормонов — вазопрессина и окситоцина. Впоследствии были синтезированы более сложные белки — инсулин и рибонуклеаза А(124 аминокислотных остатка).
У Углеводы. Функции и классификация: моносахариды, олигосахариды, полисахариды.
Название «углеводы» является историческим. Первые представители этих веществ описывались суммарной формулой СmH2nOn или Cm(H2O)n. Другое название углеводов – сахара – объясняется сладким вкусом простейших углеводов. По своей химической структуре углеводы – сложная и многообразная группа соединений. Среди них встречаются как достаточно простые соединения с молекулярной массой около 200, так и гигантские полимеры, молекулярная масса которых достигает нескольких миллионов. Наряду с атомами углерода, водорода и кислорода в состав углеводов могут входить атомы фосфора, азота, серы и, реже, других элементов.
Классификация углеводов
Все известные углеводы можно подразделить на две большие группы – простые углеводы и сложные углеводы. Отдельную группу составляют углеводсодержащие смешанные полимеры, например, гликопротеины – комплекс с молекулой белка,гликолипиды – комплекс с липидом, и др.
Простые углеводы (моносахариды, или монозы) являются полигидроксикарбонильными соединениями, не способными при гидролизе образовывать более простые углеводные молекулы. Если моносахариды содержат альдегидную группу, то они относятся к классу альдоз (альдегидоспиртов), если кетонную – к классу кетоз (кетоспиртов). В зависимости от числа углеродных атомов в молекуле моносахаридов различают триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6) и т.д.:
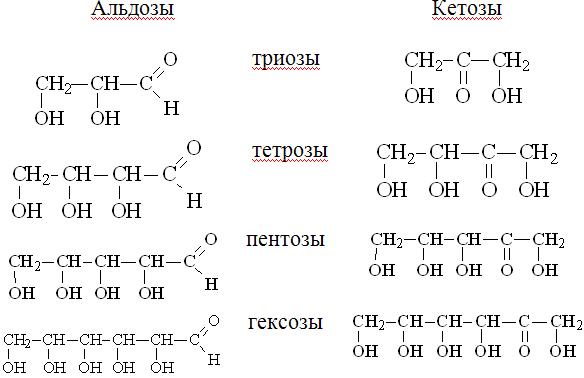
Наиболее часто в природе встречаются пентозы и гексозы.
Сложные углеводы (полисахариды, или полиозы) представляют собой полимеры, построенные из остатков моносахаридов. Они при гидролизе образуют простые углеводы. В зависимости от степени полимеризации их подразделяют на низкомолекулярные (олигосахариды, степень полимеризации которых, как правило, меньше 10) ивысокомолекулярные. Олигосахариды – сахароподобные углеводы, растворимые в воде и сладкие на вкус. Их по способности восстанавливать ионы металлов (Cu2+, Ag+) делят на восстанавливающие и невосстанавливающие. Полисахариды в зависимости от состава можно также разделить на две группы: гомополисахариды и гетерополисахариды. Гомополисахариды построены из моносахаридных остатков одного типа, а гетерополисахариды – из остатков разных моносахаридов.
Функции углеводов
Биологические функции полисахаридов весьма разнообразны.
Энергетическая и запасающая функция
В углеводах заключено основное количество калорий, потребляемых человеком с пищей. Основным углеводом, поступающим с пищей, является крахмал. Он содержится в хлебобулочных изделиях, картофеле, в составе круп. В рационе человека присутствуют также гликоген (в печени и мясе), сахароза (в качестве добавок к различным блюдам), фруктоза (во фруктах и меде), лактоза (в молоке). Полисахариды, прежде чем усвоиться организмом, должны быть гидролизованы с помощью пищеварительных ферментов до моносахаридов. Только в таком виде они всасываются в кровь. С током крови моносахариды поступают к органам и тканям, где используются для синтеза своих собственных углеводов или других веществ, либо подвергаются расщеплению с целью извлечения из них энергии.
Освобождающаяся в результате расщепления глюкозы энергия накапливается в виде АТФ. Различают два процесса распада глюкозы: анаэробный (в отсутствие кислорода) и аэробный (в присутствии кислорода). В результате анаэробного процесса образуется молочная кислота
![]() ,
,
которая при тяжелых физических нагрузках накапливается в мышцах и вызывает боль.
В результате же аэробного процесса глюкоза окисляется до оксида углерода (IV) и воды:
![]()
В результате аэробного распада глюкозы освобождается значительно больше энергии, чем в результате анаэробного. В целом при окислении 1 г углеводов выделяется 16,9 кДж энергии.
Глюкоза может подвергаться спиртовому брожению. Этот процесс осуществляется дрожжами в анаэробных условиях:
![]()
Спиртовое брожение широко используется в промышленности для производства вин и этилового спирта.
Человек научился использовать не только спиртовое брожение, но и нашел применение молочнокислому брожению, например, для получения молочнокислых продуктов и квашения овощей.
В организме человека и животных нет ферментов, способных гидролизовать целлюлозу, тем не менее целлюлоза является основным компонентом пищи для многих животных, в частности, для жвачных. В желудке этих животных в больших количествах содержатся бактерии и простейшие, продуцирующие фермент целлюлазу, катализирующий гидролиз целлюлозы до глюкозы. Последняя может подвергаться дальнейшим превращениям, в результате которых образуются масляная, уксусная, пропионовая кислоты, способные всасываться в кровь жвачных.
Углеводы выполняют и запасную функцию. Так, крахмал, сахароза, глюкоза у растений и гликоген у животных являются энергетическим резервом их клеток.
Структурная, опорная и защитная функции
Целлюлоза у растений и хитин у беспозвоночных и в грибах выполняют опорную и защитную функции. Полисахариды образуют капсулу у микроорганизмов, укрепляя тем самым мембрану. Липополисахариды бактерий и гликопротеины поверхности животных клеток обеспечивают избирательность межклеточного взаимодействия и иммунологических реакций организма. Рибоза служит строительным материалом для РНК, а дезоксирибоза – для ДНК.
Защитную функцию выполняет гепарин. Этот углевод, являясь ингибитором свертывания крови, предотвращает образование тромбов. Он содержится в крови и соединительной ткани млекопитающих. Клеточные стенки бактерий, образованные полисахаридами, скреплены короткими аминокислотными цепочками, защищают бактериальные клетки от неблагоприятных воздействий. Углеводы участвуют у ракообразных и насекомых в построение наружного скелета, выполняющего защитную функцию.
Регуляторная функция
Клетчатка усиливает перистальтику кишечника, улучшая этим пищеварение.
Ф Ферменты - биологические катализаторы. Строение ферментов. Простые и сложные ферменты.
По строению ферменты могут быть однокомпонентными, простыми белками, и двухкомпонентными, сложными белками. Во втором случае в составе фермента обнаруживается не только белковый компонент – апофермент (apoenzyme),но и добавочная группа небелковой природы – кофермент (coenzyme).
Последние вещества, в отличие от белкового компонента фермента (апофермента), имеют сравнительно небольшую молекулярную массу и, как правило, термостабильны.
Химическая природа важнейших коферментов была выяснена в 30-е годы нашего столетия благодаря трудам О. Варбурга, Р. Куна, П. Каррера и др. Оказалось, что роль коферментов в двухкомпонентных ферментах играют большинство витаминов (Е, К, Q, В1, В2, В6 В12, С, Н и др.) или соединений, построенных с участием витаминов, именно поэтому они должны поступать в организм с пищей. Многие ферменты с большой молекулярной массой проявляют каталитическую активность только в присутствии специфических низкомолекулярных веществ, называемых коферментами (или кофакторами).
Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам.
Однокомпонентные ферменты представляют собой простые белки. У однокомпонентных ферментов, не имеющих добавочной группы, которая могла бы входить в непосредственный контакт с преобразуемым соединением. Эту функцию выполняет часть белковой молекулы, называемая каталитическим центром. Предполагают, что каталитический центр однокомпонентного фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому каталитический центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Следовательно, изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности.
Кроме каталитического центра, образованного сочетанием аминокислотных радикалов или присоединением кофермента, у ферментов различают еще два центра: субстратный и аллостерический. Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества (субстрата), подвергающегося ферментативному превращению. Часто этот участок называют “якорной площадкой” фермента, где, как судно на якорь, становится субстрат. Понятие о каталитическом и субстратном центре не следует абсолютизировать. В реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго.
Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо снижением каталитической активности фермента.
Ферменты как биологические катализаторы имеют ряд особенностей, которые отличаются их от катализаторов неорганической природы:
- ферментативные реакции протекают в физиологически нормальных для живого организма условиях и не требуют жестких условий - повышенной температуры, высокой кислотности среды, избыточного давления;
- ферменты как катализаторы строго специфичны, они катализируют только определённые биохимические реакции, действуя лишь на определённый субстрат;
- ферментативные реакции в живых организмах идут последовательно, таким образом, что субстратом для каждого последующего фермента является конечный продукт предшествующий ему ферментативной реакции;
- скорость ферментативных реакций высока, но она зависит от определённых факторов. Ускоряют реакцию в 108-1020 раз. Ферментативные реакции идут со 100%-ным выходом и не дают побочным продуктов. Для выражения каталитической активности согласно рекомендациям Международного биохимического союза используется катал. Катал (кат) – это каталитическая активность, способная осуществить реакцию со скоростью, равной 1 моль в секунду;
- все ферменты являются белками. Молекулярная масса ферментов колеблется в широких пределах от 12*103 до 10*106 Да.
Ф Фибриллярные белки: аминокислотный состав, структура. Конформация и функции фибриллярных белков на примере а-кератина и коллагена.
Конформация и функции фибриллярных белков на примере а-кератина и коллагена.
Структурная организация фибриллярных белков имеет ряд особенностей по сравнению с глобулярными белками. Эти особенности можно проследить на примере кератина, фиброина и коллагена. Кератины существуют в α- и β-конформациях. α-Кератины и фиброин имеют слоисто-складчатую вторичную структуру, однако в кератине цепи параллельны, а в фиброине антипараллельны; кроме того, в кератине имеются межцепочечные дисульфидные связи, а у фиброина они отсутствуют. Разрыв дисульфидных связей приводит к разъединению полипептидных цепей в кератинах. Напротив, образование максимального числа дисульфидных связей в кератинах путем воздействия окислителей создает прочную пространственную структуру. Вообще у фибриллярных белков в отличие от глобулярных порой трудно строго разграничить разные уровни организации. Если принять (как для глобулярного белка), что третичная структура должна образовываться путем укладки в пространстве одной полипептидной цепи, а четвертичная - нескольких цепей, то в фибриллярных белках уже при формировании вторичной структуры участвует несколько полипептидных цепей. Типичным примером фибриллярного белка является коллаген, который относится к самым распространенным белкам организма человека (около 1/3 от массы всех белков). Он содержится в тканях, обладающих высокой прочностью и малой растяжимостью (кости, сухожилия, кожа, зубы и т. д.). В коллагене треть аминокислотных остатков приходится на глицин, а около четверти или чуть более — на пролин или гидроксипролин.
Изолированная полипептидная цепь коллагена (первичная структура) похожа на ломаную линию. Она содержит около 1000 аминокислот и имеет молекулярную массу порядка 105 .
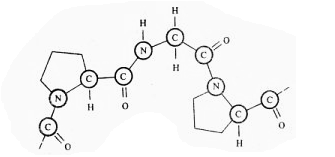
Полипептидная цепь построена из повторяющейся тройки аминокислот (триплет) следующего состава: гли-А-В, где А и В - любые, кроме глицина, аминокислоты (чаше всего пролин и гидроксипролин).
![]()
Полипептидные цепи коллагена (или α-цепи) при формировании вторичной и третичной структур не могут давать типичных α-спиралей, имеющих винтовую симметрию.
![]()
Этому мешают пролин, гидроксипролин и глицин (антиспиральные аминокислоты). Поэтому три α-цепи образуют как бы скрученные спирали подобно трем нитям, обвивающим цилиндр. Три спиральные α-цепи формируют повторяющуюся структуру коллагена, которая называется тропоколлагеном.
![]()
Тропоколлаген по своей организации является третичной структурой коллагена. Плоские кольца пролина и оксипролина, регулярно чередующиеся вдоль цепи, придают ей жесткость, как и межцепочечные связи между α-цепями тропоколлагена (поэтому коллаген устойчив к растяжению). Тропоколлаген является, по существу, субъединицей фибрилл коллагена. Укладка тропоколлагеновых субъединиц в четвертичную структуру коллагена происходит ступенеобразно.
![]()
Стабилизация структур коллагена происходит за счет межцепочечных водородных, ионных и ван-дер-ваальсовых связей и небольшого количества ковалентных связей.
α-Цепи коллагена имеют разное химическое строение. Различают α1-цепи разных видов (I, II, III, IV) и α2-цепи. В зависимости от того, какие α1- и α2-цепи участвуют в образовании трехцепочечной спирали тропоколлагена, различают четыре типа коллагена:
первый тип — две α1 (I) и одна α2-цепи;
второй тип — три α1 (II)-цепи;
третий тип — три α1 (III)-цепи;
четвертый тип — три α1 (IV)-цепи.
Наиболее распространен коллаген первого типа: он содержится в костной ткани, коже, сухожилиях; коллаген второго типа содержится в хрящевой ткани и т. д. В одном виде ткани могут быть разные типы коллагена.
Упорядоченная агрегация коллагеновых структур, их жесткость и инертность обеспечивают высокую прочность коллагеновых волокон. Коллагеновые белки содержат также углеводные компоненты, т. е. являются белок-углеводными комплексами.
Коллаген — внеклеточный белок, который образуется клетками соединительной ткани, входящей во все органы. Поэтому с повреждением коллагена (или нарушением его образования) возникают множественные нарушения опорных функций соединительной ткани органов.
Ф Физико-химические свойства белков. Изоэлектрическая точка белков.
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду
молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов.
