
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •1.Витамины, расворимые в жирах:
- •2.Витамины, расворимые в воде:
- •1. Реакции анаэробного гликолиза
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекулбелков
- •5. Растворимость белков
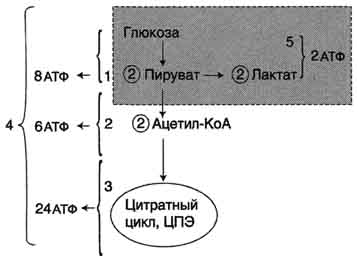
А Аэробный гликолиз, его стадии, основные реакции, ферменты и энергетическое значение.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
1. Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
2. Реакции аэробного гликолиза
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата
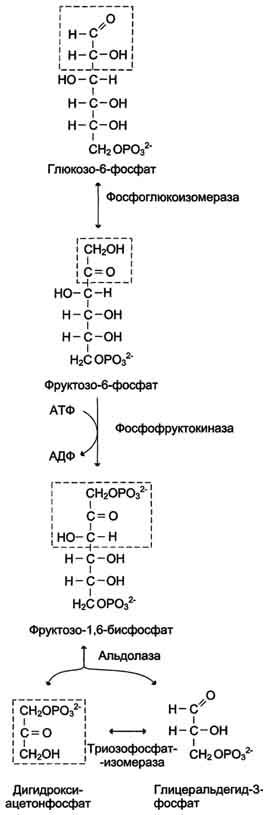
В описанной серии реакций дважды происходит фосфорилирование с использованием АТФ. Однако расходование двух молекул АТФ (на одну молекулу глюкозы) далее будет компенсировано синтезом большего количества АТФ.
Превращение глицеральдегид-3-фосфата в пируват
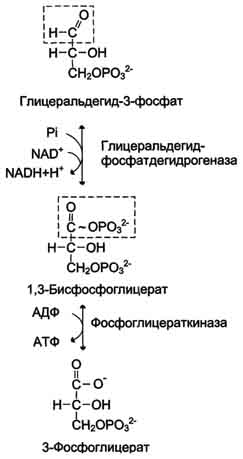
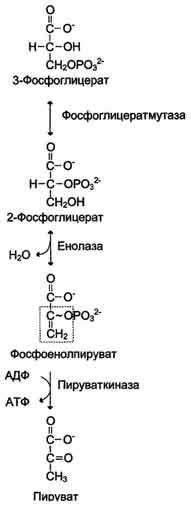
В результате гликолиза образуется пируват, который далее окисляется до СО2 и Н2О в ОПК, описанном в разделе 6. Теперь можно оценить энергетическую эффективность гликолиза и ОПК, которые вместе составляют процесс аэробного распада глюкозы до конечных продуктов.
Таким образом, выход АТФ при окислении 1 моль глюкозы до СО2 и Н2О составляет 38 моль АТФ.
Б Белки. Структурные уровни пространственной организации белков. Первичная структура белков. Биологическое значение аминокислотной последовательности.
Белки или протеины количественно преобладают над всеми другими макромолекулами живой клетки. Белки участвуют во всех биологических процессах, выполняя разнообразные функции: ферментативный катализ; транспорт и накопление; сокращение и движение; иммунная защита; передача информации в клетку; регуляция метаболизма; механическая опора и пр. Каждый белок имеет уникальную, свойственную лишь ему структуру и в такой же мере уникальную функцию, отличающуюся от функций других белков.
Структура белка
Белки — это высокомолекулярные соединения (полимеры), состоящие из a —аминокислот — мономерных звеньев, соединенных между собой пептидными связями. Все 20 аминокислот, встречающиеся в белках, это a —аминокислоты, общим признаком которых является наличие аминогруппы — NН 2 и карбоксильной группы — СООН у a —углеродного атома. a —аминокислоты отличаются друг от друга структурой группы R и, следовательно, свойствами. Все аминокислоты можно сгруппировать на основе полярности R—групп, т.е. их способности взаимодействовать с водой при биологических значениях рН.
Пептидные связи образуются при взаимодействии a —аминогруппы одной аминокислоты с a —карбоксильной группой другой аминокислоты: Пептидная связь — это амидная ковалентная связь, соединяющая аминокислоты в цепочку. Следовательно, пептиды — это цепочки аминокислот. Полипептидная цепь имеет определенное направление, так как у неё разные концы — либо свободная a —аминогруппа (N—конец), либо свободная a —карбоксильная группа (С—конец):
Изображение последовательности аминокислот в цепи начинается с N—концевой аминокислоты. С неё же начинается нумерация аминокислотных остатков. В полипептидной цепи многократно повторяется группа: —NH—CH—CO—. Эта группа формирует пептидный остов. Следовательно, полипептидная цепь состоит из остова (скелета), имеющего регулярную, повторяющуюся структуру, и отдельных боковых цепей R—групп. Первичная структура характеризуется порядком (последовательностью) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Было бы неправильно заключить, что каждый аминокислотный остаток в белке необходим для сохранения нормальной структуры и функции белка. Например, были выявлены многие варианты последовательностей гемоглобина, функционирующие нормально. Объяснение этого заключается в понимании конформации белка и будет дано позднее.
Аминокислотная последовательность белковой цепи определяет ее пространственную структуру — возникла проблема предсказания этой структуры по последовательности аминокислотных остатков в белковой цепи.
Сейчас известно уже порядка сотни тысяч белковых последовательностей. Но "всего" для нескольких тысяч из них, т.е. всего для нескольких процентов определены, рентгеном или ЯМР, их пространственные структуры. При этом многие из недавно определенных последовательностей просто считаны с ДНК или РНК, т.е. никто не определил на опыте, чем занимаются сделанные из них белки.
Б Биологические функции белков (овальбумин, рибонуклеаза А, миоглобин, гемоглобин, порин, γ-глобулины, коллаген).
Ферментативная. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов - высокоспецифичных катализаторов биохимических реакций, являющихся белками.
Строительная. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.).
В первую очередь это коллаген - основной белковый компонент внеклеточного матрикса соединительной ткани. У млекопитающих коллаген составляет до 25% общей массы белков. Коллаген синтезируется в фибробластах - основных клетках соединительной ткани.
Сократительная. Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы (актина и миозина).
Регуляторная. Важную группу составляют регуляторные белки, контролирующие биосинтез белка и нуклеиновых кислот. К регуляторным белкам относятся также пептидно-белковые гормоны, которые секретируются эндокринными железами.
Рецепторная. Информация о состоянии внешней среды, различные регуляторные сигналы (в т. ч. гормональные) воспринимаются клеткой с помощью спец. рецепторных белков, располагающихся на наружной поверхности плазматической мембраны. Эти белки играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксисе).
Транспортная. В активном транспорте ионов, липидов, сахаров и аминокислот через биологические мембраны участвуют транспортные белки, или белки-переносчики. К последним относятся также гемоглобин и миоглобин, осуществляющие перенос кислорода.
Защитная. Защитные системы высших организмов формируются защитными белками, к которым относятся иммуноглобулины (ответственны за иммунитет), белки комплемента (ответственны за лизис чужеродных клеток и активацию иммунологической функции), белки системы свертывания крови (например, тромбин, фибрин) и противовирусный белок интерферон.
Специальная. Преобразование и утилизация энергии, поступающей в организм с питанием, а также энергии солнечного излучения происходят при участии белков биоэнергетической системы (например, родопсин, цитохромы).
Питательная. Большое значение имеют пищевые и запасные белки (например, казеин, проламины), играющие важную роль в развитии и функционировании организмов.
Б Биосинтез АТФ: окислительное фосфорилирование. Дыхательная (электрон-транспортная) цепь. Компоненты и принцип действия электрон-транс портной цепи.
Дыхательная цепь (ферменты тканевого дыхания) - это переносчики протонов и электронов от окисляемого субстрата на кислород. Окислитель - это соединение, способное принимать электроны. Такая способность количественно характеризуется окислительно-восстановительным потенциалом по отношению к стандартному водородному электроду, рН которого равен 7,0. Чем меньше потенциал соединения, тем сильнее его восстанавливающие свойства и наоборот.
Т. о. любое соединение может отдавать электроны только соединению с более высоким окислительно-восстановительным потенциалом. В дыхательной цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее.
Дыхательная цепь состоит из:
НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода.
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД).
Убихинон (КоQ) отнимает водород у флавопротеидов и превращается при этом в гидрохинон.
Цитохромы - белки хромопротеиды, способные присоединять электроны, благодаря наличию в своем составе в качестве простетических групп железопорфиринов. Они принимают электрон от вещества, являющегося немного боле сильным восстановителем, и передают его более сильному окислителю. Атом железа связан с атомом азота имидазольного кольца аминоксилоты гистидина с одной стороны от плоскости порфиринового цикла, а с другой стороны с атомом серы метионина. Поэтому потенциальная способность атома железа в цитохромах к связыванию кислорода подавлена.
В цитохроме с порфириновая плоскость ковалентно связана с белком через два остатка цистеина, а в цитохромах b и а, она ковалентно не связано с белком.
В цитохроме а+а3 (цитохромоксидазе) вместо протопорфирина содержатся порфирин А, который отличатся рядом структурных особенностей. Пятое координационное положение железа занято аминогруппой, принадлежащей остатку аминосахара, входящего в состав самого белка.
В отличии от гема гемолгобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов.
Механизм работы электронтранспортной цепи
Наружная мембрана митохондрии проницаема для большинства мелких молекул и ионов, внутренняя почти для всех ионов (кроме протонов Н) и для большинства незаряженных молекул.
Все вышеперечисленные компоненты дыхательной цепи встроены во внутреннюю мембрану. Транспорт протонов и электронов по дыхательной цепи обеспечивается разностью потенциалов между ее компонентами. При этом каждое увеличение потенциала на 0,16 В освобождает энергию, достаточную для синтеза одной молекулы АТФ из АДФ и Н3РО4. При потреблении одной молекулы О2 образуется 3АТФ.
Процессы окисления и образования АТФ из АДФ и фосфорной кислоты т.е. фосфорилирования протекают в митохондриях. Внутренняя мембрана образует множество складок - крист. Пространство органиченное внутренней мембраной - матриксом. Пространство между внутренней и наружной мембранами называется межмембранным.
Такая молекула содержит в себе три макроэргических связи. Макроэргической или богатой энергией называют химическую связь, при разрыве которой высвобождается более 4 ккал/моль. При гидролитическом расщеплении АТФ до АДФ и фосфорной кислоты высвобождается 7,3 ккал/моль. Ровно столько же тратится для образования АТФ из АДФ и остатка фосфорной кислоты и это один из основных путей запасания энергии в организме.
В процессе транспорта электронов по дыхательной цепи высвобождается энергия, которая тратится на присоединение остатка фосфорной кислоты к АДФ с образованием одной молекулы АТФ и одной молекулы воды. В процессе переноса одной пары электронов по дыхательной цепи высвобождается и запасается в виде трех молекул АТФ 21,3 ккал/моль. Это составляет около 40 % высвободившейся при электронном транспорте энергии.
Такой способ запасания энергии в клетке называется окислительным фосфорилированием или сопряженным фосфорилированием.
Механизм окислительного фосфорилирования:
1) НАД-зависимая дегидрогеназа расположена на матриксной поверхности внутренней мембраны митохондрий отдает пару электронов водорода на ФМН-зависимую дегидрогеназу. При этом из матрикса пара протонов переходит также на ФМН и в результате образуется ФМН Н2. В это время пара протонов, принадлежащих НАД выталкивается в межмембранное пространство.
2) ФАД-зависимая дегидрогеназа отдает пару электронов на КоQ а пару протонов выталкивает в межмембранное пространство. Получив электроны КоQ принимает из матрикса пару протонов и превращается в КоQ Н2.
3) КоQ Н2 выталкивает пару протонов в межмембранное пространство, а пара электронов передается на цитохромы и далее на кислород с образованием молекулы воды.
В итоге при переносе пары электронов по цепи из матрикса в межмембранное пространство перекачивается 6 протонов (3 пары), что ведет к созданию разницы потенциалов и разницы рН между поверхностями внутренней мембраны.
4) Разница потенциалов и разница рН обеспечивают движение протонов через протонный канал обратно в матрикс.
5) Такое обратное движение протонов ведет к активации АТФ-синтазы и синтезу АТФ из АДФ и фосфорной кислоты. При переносе одной пары электронов (т.е. трех пар протонов) синтезируется 3 молекулы АТФ.
Разобщение процессов дыхания и окислительного фосфорилирования происходит если протоны начинают проникать через внутреннюю мембрану митохондрий. В этом случае выравнивается градиент рН и исчезает движущая сила фосфорилирования. Химические вещества - разобщители называются протонофорами, они способны переносить протоны через мембрану. К таковым относятся 2,4 -динитрофенол, гормоны щитовидной железы и др.
Образовавшаяся АТФ из матрикса в цитоплазму переносится ферментами транслоказами, при этом в обратном направлении в матрикс переносится одна молекула АДФ и одна молекула фосфорной кислоты. Понятно, что нарушение транспорта АДФ и фосфата тормозит синтез АТФ.
Скорость окислительного фосфорилирования зависит в первую очередь от содержания АТФ, чем быстрее она расходуется, тем больше накапливается АДФ, тем больше потребность в энергии и следовательно активнее идет процесс окислительного фосфорилирования. Регуляцию скорости окислительного фосфорилирования концентрацией в клетке АДФ называют дыхательным контролем.
Б Биосинтез АТФ: субстратное фосфорилирование.
Субстратное
фосфорилирование — это синтез АТФ за
счет переноса высокоэнергетического
ортофосфата (Н3Р04) от окисляемого
субстрата на АДФ. Такое фосфорилирование
происходит в основном в мышцах при
анаэробном окислении глюкозы с участием
высокоспецифических ферментов. Примером
может служить окисление 2-фосфоглицериновой
кислоты в процессе превращения ее в
пировиноградную кислоту. Механизм
образования АТФ в этой реакции связан
с внутримолекулярным окислением
2-фосфоглицериновой кислоты и превращением
ее в макроэргическое соединение —
фосфоэнолпировиноградную
кислоту:
 Фосфоэнолпировиноградная
кислота благодаря ферменту пируваткиназе
способна передавать высокоэнергетический
фосфат на АДФ с образованием АТФ и
пировиноградной кислоты:
Фосфоэнолпировиноградная
кислота благодаря ферменту пируваткиназе
способна передавать высокоэнергетический
фосфат на АДФ с образованием АТФ и
пировиноградной кислоты:
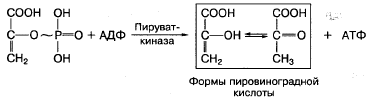 За
счет реакций субстратного фосфорилирования
образуется сравнительно небольшое
количество АТФ в клетке.
Окислительное
фосфорилирование — это синтез АТФ за
счет энергии, которая выделяется при
переносе электронов по дыхательной
цепи от окисляемых питательных веществ
к атомарному кислороду. Окислительное
фосфорилирование является основным
механизмом образования АТФ в аэробных
условиях.
Субстратное фосфорилирование
и окислительное фосфорилирование
характеризуются разной степенью
сопряженности между реакциями,
протекающими с освобождением и накоплением
энергии. При субстратном фосфорилировании
окисление тесно связано с образованием
первичного макроэргического соединения.
При окислительном фосфорилировании
окисление в дыхательной цепи непосредственно
не связано с синтезом АТФ и первоначально
используется для образования протонного
потенциала, который в дальнейшем приводит
к синтезу АТФ. Энергия протонного
потенциала может затрачиваться и на
другие виды работы, поэтому образование
АТФ не является единственным и обязательным
следствием окисления.
За
счет реакций субстратного фосфорилирования
образуется сравнительно небольшое
количество АТФ в клетке.
Окислительное
фосфорилирование — это синтез АТФ за
счет энергии, которая выделяется при
переносе электронов по дыхательной
цепи от окисляемых питательных веществ
к атомарному кислороду. Окислительное
фосфорилирование является основным
механизмом образования АТФ в аэробных
условиях.
Субстратное фосфорилирование
и окислительное фосфорилирование
характеризуются разной степенью
сопряженности между реакциями,
протекающими с освобождением и накоплением
энергии. При субстратном фосфорилировании
окисление тесно связано с образованием
первичного макроэргического соединения.
При окислительном фосфорилировании
окисление в дыхательной цепи непосредственно
не связано с синтезом АТФ и первоначально
используется для образования протонного
потенциала, который в дальнейшем приводит
к синтезу АТФ. Энергия протонного
потенциала может затрачиваться и на
другие виды работы, поэтому образование
АТФ не является единственным и обязательным
следствием окисления.
Б Биосинтез олигосахаридов и полисахаридов.
Биосинтез крахмала и гликогена хорошо изучен. В основном он заключается в следующем.
Под влиянием фермента фосфорилазы от 1-фосфата глюкозы отщепляется неорганический фосфат, а остаток глюкозыприсоединяется к невосстанавливающему концевому глюкозному остатку полисахаридной цепи.
Синтез сводится к удлинению цепи, поэтому для начала процесса необходима «затравка» в виде небольшого количества полисахаридов (крахмала или гликогена) или продуктов их расщепления, состоящих из сравнительно небольшого числа глюкозных остатков.
В результате описанного процесса образуется неразветвленная цепь, и первые попытки получить высшие полиозы in vitro при помощи лишь одного фермента — фосфорилазы приводили к синтезу полисахаридов типа амилозы. Для получения разветвленных структур необходимы другие ферменты, способные в отличие от фосфорилазы создавать связи α-1,6'. Такиеферменты были найдены как в растительных, так и в животных организмах. В настоящее время при помощи этих ферментовпроизведены in vitro ферментативные синтезы как амилозы и амилопектина, так и гликогена. В последние годы открыт новый путь биосинтеза полисахаридов типа гликогена, заключающийся в наращивании полиглюкозидной цепи в результате присоединения глюкозных остатков из нуклеотида — уридиндифосфата глюкозы.
Декстран — высшая полиоза, образующаяся из сахарозы под влиянием Leuconostoc mesenteroides и некоторых другихмикроорганизмов при отщеплении фруктозы и соединении остатков глюкозы в полигликозидные цепи:
![]()
Молекулярный вес декстрана — от нескольких миллионов до нескольких десятков миллионов. Остатки глюкозы соединены вдекстране преимущественно α-1,6'-гликозидными связями; в точках ветвления имеются 1,4'- или 1,3'-связи. Препараты частично гидролизованных декстранов (с молекулярным весом 30 000—60 000) в последние годы получили широкое применение в качестве заменителей крови (например, советский препарат — полиглюкин).
Б Биосинтез углеводов. Биосинтез глюкозы (глюконеогенез): основные реакции и ферменты.
Анаболизм углеводов в тканях в основном характеризуется процессами биосинтеза глюкозы и гликогена. Образование глюкозы из не углеводных компонентов называют глюконеогенез (образование нового сахара). Важными предшественниками D – глюкозы являются : лактат, пируват, глицерин, большинство аминокислот и промежуточные продукты цикла лимонной кислоты: яблочная кислота, ЩУК, α-кетоглутаровая кислота, янтарная кислота и др. Эти вещества могут образовываться при распаде жиров (например, глицерина), белков, содержащих аминокислоты, производные пропионовой кислоты: аланин, фенилаланин, серин и др.
Глюконеогенез - это синтез глюкозы из неуглеводных предшественников. У млекопитающих эту функцию выполняет в основном печень, в меньшей мере - почки и клетки слизистой кишечника. Запасов гликогена в организме достаточно для удовлетворения потребностей в глюкозе в период между приемами пищи. При углеводном или полном голодании, а также в условиях длительной физической работы концентрация глюкозы в крови поддерживается за счет глюконеогенеза. В этот процесс могут быть вовлечены вещества, которые способны превратиться в пируват или любой другой метаболит глюконеогенеза.
Причем, использование первичных субстратов в глюконеогенезе происходит в различных физиологических состояниях. Так, в условиях голодания часть тканевых белков распадается до аминокислот, которые затем используются в глюконеогенезе. При распаде жиров образуется глицерин, который через диоксиацетонфосфат включается в глюконеогенез. Лактат, образующийся при интенсивной физической работе в мышцах, затем в печени превращается в глюкозу. Следовательно, физиологическая роль глюконеогенеза из лактата и из аминокислот и глицерина различна. Синтез глюкозы из пирувата протекает, как и при гликолизе, но в обратном направлении.
Глюконеогенез. Ферменты: 1-пируваткарбоксилаза, 2-фосфоенолпируваткарбоксикиназа, 3-фосфатаза фру-1,6-дифосфата, 4-глюкозо-6-фосфатаза.
Семь реакций гликолиза легко обратимы и используются в глюконеогенезе. Но три киназные реакции необратимы и должны шунтироваться. Так, фруктозо-1,6-дифосфат и глюкозо-6-фосфат дефосфорилируются специфическими фосфатазами, а пируват фосфорилируется до образования фосфоенолпирувата посредством двух промежуточных стадий через оксалоацетат. Образование оксалоацетата катализируется пируваткарбоксилазой. Этот фермент содержит в качестве кофермента биотин. Оксалоацетат образуется в митохондриях, транспортируется в цитозоль и включается в глюконеогенез. Следует обратить внимание на то, что каждая из необратимых реакций гликолиза вместе с соответствующей ей необратимой реакцией глюконеогенеза составляют цикл, называемый субстратным.
Глюконеогенез, необратимые реакции. Таких циклов существует три - соответственно трем необратимым реакциям. Результатом одновременного протекания реакций субстратных циклов будет расходование энергии. Субстратные циклы могут протекать в условиях нормального обмена веществ в печени и имеют вполне определенное биологическое значение. Кроме того, эти циклы служат точками приложения регуляторных механизмов, в результате чего изменяется поток метаболитов либо по пути распада глюкозы, либо по пути ее синтеза. Суммарное уравнение глюконеогенеза из пирувата:
2 пируват + 4 ATФ + 2 GTP + 2(NADH) + 4 Н2О Глюкоза + 4 ADP + 2 GDP + 2 NAD+ + 6 Н3РО4.
За сутки в организме человека может синтезироваться до 80 г глюкозы. На синтез 1 моль глюкозы из пирувата расходуется 6 макроэргических связей (4 ATФ и 2 GTP).
В Витамины. Номенклатура и классификация. Биологическая роль.
Витамины (от лат. vita — жизнь) — класс биологически активных соединений, объединяемых по признаку строгой необходимости в обмене веществ в организме человека и животных; это низкомолекулярные пищевые вещества различной химической природы, причем требуются они организму в ничтожно малых количествах (от нескольких мкг до нескольких мг в сутки).
Организм человека и животных не синтезирует витамины или синтезирует их в небольшом количестве. В отличие от других незаменимых факторов (незаменимых аминокислот, полиненасыщенных жирных кислот), витамины не являются пластическими веществами или источником энергии и участвуют в обмене веществ не как субстраты биохимических реакций, а как участники процессов биокатализа и регуляции этих реакций. Они часто входят в состав коферментов, необходимых для функционирования биологических катализаторов — ферментов.
Недостаток витаминов в организме приводит к развитию гипови-таминозов, а полное их отсутствие — авитаминозов, к нарушению обмена веществ и к тяжелым заболеваниям.
Витамины делят на две большие группы: витамины растворимые в жирах, и витамины, растворимые в воде.
