
- •1 Частина
- •2 Частина
- •3 Частина
- •3.2 Дано: Розв'язання
- •3.3 Дано: Розв'язання
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •3 .2 Дано: Розв'язання
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
2 Частина
2.1
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;
2Na+
+ C + 2H+
+ 2Сl–
= 2Na+
+ 2Сl–
+ H2O
+ CO2↑;
+ 2H+
+ 2Сl–
= 2Na+
+ 2Сl–
+ H2O
+ CO2↑;
2H+ + C = H2O + CO2↑.
2.2
Д ано: Розв’язання
m(K2SO4) = 43,5 г.
N (K+ + S ) – ? 1. Знаходимо кількість речовини калій сульфату:
v(K2SO4) = m(K2SO4) : M(K2SO4) = 43,5 г : 174 г/моль = 0,25 моль.
2.Визначаємо кількість формульних одиниць калій сульфату: N(K2SO4) =
= v(K2SO4)·NA = 0,25 моль · 6,02 · 1023 форм, од./моль = 1,505 · 1023 форм. од.
3.Електролітична дисоціація калій сульфату відбувається за рівнянням:
K2SO4
 2К+
+ S
2К+
+ S
Як видно з рівняння, під час електролітичної дисоціації однієї формульної одиниці калій сульфату утворюються 3 йони (2 йони Калію й один сульфат-іон), тому загальна кількість йонів становить:
N(K+
+
 )
= 3 · N(K2SO4)
= 3 · 1,505 · 1023
форм. од. = 4,515·1023
йонів.
)
= 3 · N(K2SO4)
= 3 · 1,505 · 1023
форм. од. = 4,515·1023
йонів.
Відповідь: N(K+ + S ) = 4,515 · 1023 йонів.
2.3
Д ано: Розв’язання
N (NH3) – 1,204 • 10 молекул. 1. Знаходимо кількість речовини амоніаку: m(NH3) –? v(NH3) = N(NH3): NA =
= 1,204 • 1023 молекул : 6,02 • 1023 молекул/моль = 0,2 моль.
2. Обчислюємо масу амоніаку:
M(NH3) =17 г/моль;
т(NH3) = v(NH3) • M(NH3) = 0,2 моль • 17 г/моль = 3,4 г.
Відповідь: m(NH3) = 3,4 г.
2.4
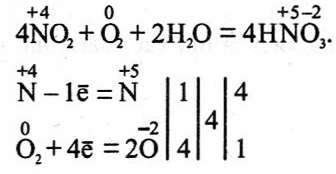
3 Частина
3.1

С
Н3—СН—СН3 СН— СН
СН— СН СН2;
СН2;
ОН
СН — СН = СН2 + Н2 → С3Н8;
С3Н8 + 5O2 → 3СO2 + 4Н2O;
СО2 + С → 2СО.
3 .2 Дано: Розв’язання
V1 (С2Н4) =5 л; 1. Етан з воднем не реагує. Етен реагує з воднем відповідно V1(С2Н6) = 3 л; до рівняння: С2Н4 + Н2 → С2Н6.
V1(Н2) = 2 л. Як видно з рівняння: V(C2H4) = V(H2) = V(C2H6).
V 2(C2H4) – ? Отже, для взаємодії із 2 л водню потрібно 2 л етену, унаслі-
V2(C2H6) – ? док чого утворюється 2 л етану.
2. Знаходимо об’єм етену, який залишився після реакції:
V2(C2H4) = V1(C2H4) – V(C2H4) = 5л–2л = 3л.
3. Знаходимо об’єм етану, який залишився після реакції:
V2(C2H6) = V1(C2H6) + V(C2H6) = 3л + 2 л = 5 л.
Відповідь: V2(C2H4) = 3 л; V2(C2H6) = 5 л.
3.3
Д ано: Розв’язання
т(К + Са) = 30 г; Масу калію в суміші позначимо х, тоді маса кальцію
V(Н2) = 12,544 л. становить 30 – х.
w (K) – ? 1. Знайдемо об’єм V1 водню, який виділиться під час
w(Ca) –? взаємодії калію з водою:
x V1
2К + 2Н2O = 2КОН + Н2.
2 × 39 г 22,4 л
Під час взаємодії 78 г калію з водою виділяється 22,4 л водню, а під час взаємодії х г калію — V1 л водню. Отже, х : 78 = V1 : 22,4.
Звідки V1 = 22,4x : 78.
2.Обчислюємо об’єм V2 водню, який виділиться під час взаємодії кальцію з водою:
30 – х V2
Са + 2Н2O = Са(ОН)2 + Н2.
40 г 22,4 л
M(Ca) = 40 г/моль.
Під час взаємодії 40 г кальцію з водою виділяється 22,4 л водню, а під час взаємодії 30 – х г кальцію — V2 л водню. Отже,
40 : (30 – x) = 22,4 : V2.
Звідси V2 = 22,4(30 – x) : 40 = 0,56 (30 – х).
3.Знаходимо масу калію в суміші. За умовою задачі:
V(H2) = V1 + V2;
12,544 = 22,4x : 78 + 0,56(30 – х);
978,432 = 22,4x + 43,68(30 – x:);
978,432 = 22,4 х+ 1310,4 – 43,68x;
21,28x: = 331,968;
х = 15,6;
m(К)= 15,6 г.
4.Обчислюємо масову частку калію в суміші:
w(К) = m(К) : m(К + Са) = 15,6 г : 30 г = 0,52 = 52 %.
5.Знаходимо масову частку кальцію в суміші:
w(Cа) = 100% – 52% = 48 %.
Відповідь: w(K) = 52 %, w(Cа) = 48 %.
9 ВАРІАНТ.
