
- •1 Частина
- •2 Частина
- •3 Частина
- •3.2 Дано: Розв'язання
- •3.3 Дано: Розв'язання
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •3 .2 Дано: Розв'язання
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
3 Частина
3.1
Mg + H2SO4 = MgSO4 + H2;
MgSO4 + Na2CO3 = MgCO3 + Na2SO4;
MgCO3 + 2HCl = MgCl2 + H2O + CO2;
MgCl2 + 2AgNO3 = Mg(NO3)2 + 2AgCl↓.
3.2
Д ано: Розв'язання
m(р-ну Са(ОН)2) - 240 г; 1. Знаходимо масу кальцій гідроксиду в w(Ca(OH)2) = 3,7% = 0,037; розчині:
wСН3СООН)
= 12 % = 0,12.
m(Ca(OH)2)
=
 =
=
m (p-нy СН3СООН) — ?
=
2. Знаходимо масу етанової (оцтової) кислоти, яку потрібно використати для нейтралізації кальцій гідроксиду:
x 8,88 г
2СН3СООН + Са(ОН) = (СН3СОО)2Са + 2Н2О.
2 × 60 г 74 г
Для нейтралізації 74 г Са(ОН)2 потрібно 120 г оцтової кислоти, а для нейтралізації 8,88 г Са(ОН)2 — x г кислоти. Отже: x : 120 = 8,88 : 74.
Звідки
х
=
 = 14,4 (г).
= 14,4 (г).
3. Знаходимо масу розчину кислоти:
оскільки
w(CH3COOH)
=  · 100%, то
· 100%, то
m(р-ну
СН3СООН)
=
 • 100 % =
• 100 % =
 · 100 % = 120 г.
· 100 % = 120 г.
Відповідь: m(р-ну СН3СООН) = 120 г
3.3
Д ано: Розв'язання
m(СnН2n–6) = 3,68 г; 1 Записуємо рівняння реакції горіння арену:.
V(СО2) = 6,272 л 3,68 г 6,272 л
С
nН2n–6
— ? CnH2n–6
+
 О2
= СО2
+ (n – 3)Н2О.
О2
= СО2
+ (n – 3)Н2О.
14n - 6 n · 22,4 л
Мr(СnН2n–6) = 12n + 2n – 6 = 14n – 6.
Під час згоряння 3,68 г арену утворилось 6,272 л вуглекислого газу, а
під час згоряння (14n - 6) г арену — 22,4n л. Отже,
3,68 : (14n – 6) = 6,272 : 22,4n.
Звідки 3,68 · 22,4n = (14n – 6) · 6,272;
82,432n = 87,808n – 37,632;
5,376n = 37,632;
n = 7.
Відповідь: формула арену — С7Н8.
6 ВАРІАНТ.
1 Частина
1.1 |
1.2 |
1.3 |
1.4 |
1.5 |
1.6 |
в |
в |
б |
б |
А, г |
А,в |
1.7 |
1.8 |
||
А |
2 |
А |
3 |
Б |
4 |
Б |
4 |
В |
1 |
В |
2 |
Г |
3 |
Г |
1 |
2 Частина
2.1
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3;
3Na+
+ P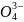 + 3 Ag+
+ 3 N
= Ag3PO4↓
+ 3Na+
+ 3 N
;
+ 3 Ag+
+ 3 N
= Ag3PO4↓
+ 3Na+
+ 3 N
;
3Ag+
+
 = Ag3PO4↓.
= Ag3PO4↓.
2.2
Д ано: Розв'язання
φ(CH4) = 95 %; 1 Обчислюємо об'єм метану. Оскільки
V(прир.
газу) = 12 л. φ (СН4)
=

N (CH4) — ?
V(CH4)
= =
=
 =11,4 л.
=11,4 л.
2. Обчислюємо кількість речовини метану:
v(CH4) = V(CH4): VM = 11,4 л : 22,4 л/моль = 0,51 моль.
3. Обчислюємо кількість молекул метану: N(CH4) = v(CH4) · NA =
= 0,51 моль · 6,02 · 1023 молекул/моль = 3,07 · 1023 молекул.
Відповідь: N(CH4) = 3,07 · 1023 молекул.
2.3
Д ано: Розв'язання
V(CO) = 5,6 л; 1. Обчислюємо кількість речовини карбон(ІІ) оксиду:
V (СО2) = 8,96 л. v(CO) = V(CO): VM = 5,6 л : 22,4 л/моль = 0,25 моль. m(суміші) — ?
2. Знаходимо масу карбон(ІІ) оксиду:
m(CO) = v(CO) • М(СО) = 0,25 моль • 28 г/моль = 7 г.
3. Знаходимо кількість речовини карбон(ІV) оксиду:
v(CO2) = V(CO2): VM = 8,96 л : 22,4 л/моль = 0,4 моль.
4. Знаходимо масу карбон(ІV) оксиду:
М(СО2) = 44 г/моль;
m(CO2) = v(CO2) • М(СО2) = 0,4 моль • 44 г/моль = 17,6 г.
