
- •1 Частина
- •2 Частина
- •3 Частина
- •3.2 Дано: Розв'язання
- •3.3 Дано: Розв'язання
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •3 .2 Дано: Розв'язання
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •5. Обчислюємо масу суміші:
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
- •1 Частина
- •2 Частина
- •3 Частина
1 Частина
1.1 |
1.2 |
1.3 |
1.4 |
1.5 |
1.6 |
а |
б |
в |
а |
Б,г |
Г,д |
1.7 |
1.8 |
||
А |
1 |
А |
5 |
Б |
3 |
Б |
4 |
В |
4 |
В |
3 |
Г |
2 |
Г |
1 |
2 Частина
2.1
ВаСl2 + Na2SO4 = BaSO4↓ + 2NaCl;
Ba2+ + 2Сl– + 2Na+ + S = BaSO4↓ + 2Na+ + 2Сl– ;
Ba2+ + S = BaSO4↓.
2.2
Д ано: Розв’язання
w1(p-нy KOH) = 250 г; 1. Знаходимо масу KOH у розчині:
m1(КОН) = 28 % = 0,28; m(KOH) = m1(p-нy KOH) · w1(KOH) =
m(Н2O) = 25 г. = 250 г · 0,28 = 70 г.
w 2(KOH) — ? 2. Визначаємо масу отриманого розчину:
m2(р-ну КОН) = m1(р-ну KOH) - m(Н2O) = 250 г - 25 г = 225 г.
3. Обчислюємо масову частку КОН в отриманому розчині:
w2(KOH) = m(KOH): m2(р-ну КОН) = 70 г : 225 г = 0,311 = 31,1 %.
Відповідь: w2(KOH) = 31,1 %.
2.3
Д ано: Розв’язання
С3Н8O3. Один моль будь-якої речовини містить 6,02 • 1023
m (молекули С3Н8O3) — ? (число Авогадро) структурних частинок (атомів,
молекул, йонів). Отже, 1 моль гліцеролу С3Н8O3 містить 6,02 • 1023 молекул С3Н8O3.
1.Знаходимо молярну масу С3Н8O3:
М(С3Н8O3) = 12 • 3 + 1 • 8 + 16 • 3 = 92 г/моль.
2.Обчислюємо масу однієї молекули С3Н8O3: m(молекули С3Н8O3) =
= М( С3Н8O3): NA = 92 г/моль : 6,02 • 1023 молекул/моль = 1,53 • 10–22 г.
Відповідь: m(молекули С3Н8O3) = 1,53 • 10-22 г.
2.4

3 Частина
3.12
СН3Сl + 2Na → С2Н6 + 2NaCl;
С2Н6 → С2Н4 + Н2;
С2Н4 + Н2O — С2Н5ОН;
С2Н5ОН + CuO → СН3СНО + Сu + Н2O.
3.2
Д ано: Розв’язання
m(Ме(ОН)3) = 23,54 г; 1. Відносну атомну масу невідомого металічного
m(Ме2O3) = 17,6 г. елемента Me позначимо х. Термічний розклад гід-
m (Ме) – ? роксиду тривалентного металічного елемента від–
бувається згідно з рівнянням реакції:
23,54 г 17,6г
2Ме(ОН)3 = Ме2O3 + 3Н2O.
2(x + 51) 2х + 48
М(Ме(ОН)3) = 2[х + (16 + 1) • 3] = 2(х + 51);
М(Ме2O3) = 2х + 16 • 3 = 2х + 48.
Знаходимо відносну атомну масу невідомого металічного елемента:
під час розкладу 23,54 г Ме(ОН)3 утворюється 17,6 г Ме2O3, а під час розкладу 2(х + 51) г Ме(ОН)3 — 2х + 48 г Ме2O3.
Отже,
23,54 : 2(х + 51) = 17,6 : 2х + 48;
23,54 • (2х + 48) = 17,6 • 2(х+ 51);
47,08x + 1129,92 = 35,2х + 1795,2;
44,88x = 665,28;
х = 56.
Невідомий металічний елемент — Ферум.
2.Обчислюємо масу заліза:
17,6 г у
Fe2O3 + 3СО = 2Fe + 3СO2.
160 г 2 · 56 г
Під час відновлення 160 г Fe2O3 утворюється 112 г Fe, а під час відновлення 17,6 г Fe2O3 —у г Fe.
Складаємо пропорцію: 17,6 : 160 = у : 112.
Звідки у=
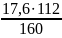 = 12,32 (г).
= 12,32 (г).
Відповідь: m(Fe) = 12,32 г.
3.3
Д ано: Розв’язання
m(суміші) = 300 г; 1. Знаходимо масу розчину калій гідроксиду:
V(p-нy КОН) = 200 мл; m(р-ну КОН) = V(p-нy КОН) • ρ(р-ну КОН) = 240 г.
ρ(р-ну КОН) = 1,2 г/мл; 2. Обчислюємо масу калій гідроксиду в розчині:
w(KOH) = 22,4%= 0,224. m(KOH) = т(р-ну КOН) • w(КOН) =
w (C2H5OH) — ? = 240 г • 0,224 = 53,76 г.
3. За звичайних умов етанол з лугом не взаємодіє. Знаходимо масу фенолу в розчині:
х 53,76 г
С6Н5ОН + КОН → С6Н5ОК + Н2O.
94 56 г
94 г С6Н5ОН вступають у реакцію з 56 г КОН, а х г С6Н5ОН — з 53,76 г КОН.
Складаємо пропорцію: х : 94 = 53,76 : 56.
Звідки х
=
 = 90,24 (г);
= 90,24 (г);
m(С6Н5ОН) = 90,24 г.
4. Визначаємо масу етанолу в суміші:
w(C2H5OH) = m(суміші) – m(С6Н5ОН) = 300 г – 90,24 г = 209,76.
5. Обчислюємо масову частку етанолу в суміші:
w(C2H5OH) = m(C2H5OH) : m(суміші) = 209,76 г : 300 г = 0,699 = 69,9 %. Відповідь: w(С2Н5ОН) = 69,9 %.
11 ВАРІАНТ.
