
- •Дипломна робота бакалавра
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2 30
- •1. Огляд літератури
- •1.1. Аутологічні антитіла, їх продукція та характеристики
- •1.2. Функціональна активність аутоантитіл у нормі та при аутоімунних захворюваннях
- •1.3. Аутоімунні захворювання
- •1.3.1. Системний червоний вовчак – системна імунопатія
- •1.3.2. Розсіяний склероз
- •1.4. Антитіла із каталітичною ензимоподібною активністю – абзими
- •Полісахарид-гідролізуючі абзими;
- •Абзими, що володіють сіалідазною активністю.
- •1.5. Роль процесів сіалування/десіалування у функціонуванні імунної системи
- •1.5.1. Структура та функції сіалових кислот
- •1.5.1.1. Структура сіалових кислот
- •1.5.1.2. Значення сіалових кислот для функціонування імунної системи
- •1.5.2. Вплив процесів сіалування-десіалування на структуру та функції імуноглобулінів
- •1.5.3. Анти-сіалільні антитіла у нормі та при патології
- •1.5.3.1. Абзими, що володіють сіалідазною активністю
- •2. Матеріали і методи досліджень
- •2.1. Реактиви і матеріали
- •2.2. Методи досліджень
- •2.2.1. Очищення антисіалільних IgG-антитіл із сироватки крові хворих на счв та рс
- •2.2.2. Одержання (Fab)2 антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2
- •2.2.4. Визначення сіалідазної (нейрамінідазної) активності IgG після ренатурації із пааг
- •2.2.5. Інгібування сіалідазної активності антисіалільних IgG-антитіл інгібіторами клітинних сіалідаз
- •2.2.6. Електрофоретичне розділення білків у пааг.
- •3. Результати досліджень та їх обговорення
- •3.1. Виділення та очистка IgG із сироватки крові хворих на счв та визначення їхньої сіалідазної активності
- •3.2. Виділення та очистка антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •3.3. Дослідження сіалідазної активності та субстратної специфічності антисіалільних IgG-антитіл
- •3.4. Інгібування сіалідазної активності антисіалільних IgG-антитіл
- •3.5. Визначення сіалідазної активності антисіалільних IgG-антитіл, ренатурованих з пааг
- •3.6. Одержання (Fab)2 антисіалільних IgG-антитіл
- •3.7. Визначення сіалідазної активності (Fab)2 антисіалільних IgG-антитіл
- •3.8. Дослідження сіалідазної активності антитіл сироватки крові хворих на розсіяний склероз
- •4. Охорона праці Вступ
- •4.1. Аналіз стану умов праці
- •4.1.1. Характеристика лабораторії
- •4.1.2.Аналіз методів дослідження та характеристика обладнання
- •4.1.3. Характеристика об'єкту дослідження, речовин, їхніх небезпечних властивостей
- •4.2. Організаційно–технічні заходи
- •4.2.1.Організація робочого місця і роботи
- •4.2.2. Санітарно–гігієнічні вимоги до умов праці
- •4.2.3. Заходи щодо безпеки під час роботи з обладнанням, об'єктом дослідження і речовинами
- •4.3. Безпека у надзвичайних ситуаціях
- •4.3.1. Протипожежні та проти вибухові заходи
- •4.3.2. Організація евакуації працівників
3.4. Інгібування сіалідазної активності антисіалільних IgG-антитіл
Відомо, що клітинні ферменти сіалідази зазнають інгібування під дією таких речовин, як DANA (2-дезокси-2,3-дидегідро-N-ацетилнейрамінова кислота) та озельтамівір. Показано, що DANA є інгібітором-аналогом перехідного стану ферментативної реакції, що каталізується сіалідазами [63]. Натомість озельтамівір є конкурентним інгібітором дії сіалідаз [63]. У реакційну суміш для визначення сіалідазної активності хворих на СЧВ було додано зазначені інгібітори до кінцевої концентрації 15 μМ. Як видно з рис. 6, сіалідазна активність IgG сироватки крові хворих на СЧВ пригнічується типовими інгібіторами внутрішньоклітинних сіалідаз – DANA та озельтамівір. Ці дані додатково підтверджують факт того, що знайдені імуноглобуліни можуть бути віднесені до анти-сіалільних абзимів. Окрім того, результати вказують на можливість схожості каталізу між ензимами та абзимами в організмі людини.
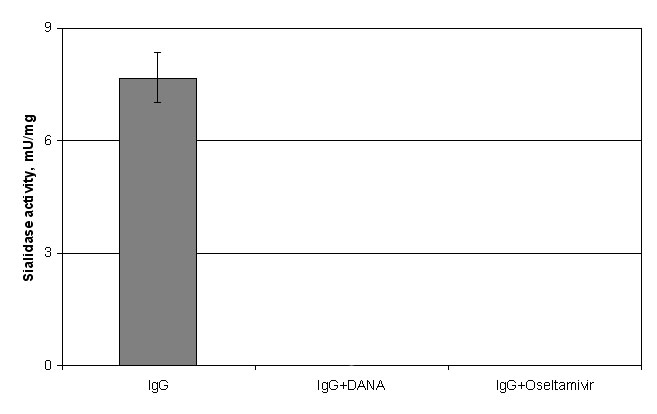
Рис. 6. Інгібування сіалідазної активності антисіалільних IgG-антитіл за допомогою інгібіторів клітинних сіалідаз: IgG – фракція IgG, що проявляє сіалідазну активність; IgG+DANA – фракція IgG, попередньо проінкубована з 15 μМ DANA; IgG+Oseltamivir – фракція IgG, попередньо проінкубована з 15 μМ Oseltamivir
3.5. Визначення сіалідазної активності антисіалільних IgG-антитіл, ренатурованих з пааг
Для подальшого дослідження антисіалільних IgG їх розділяли шляхом електрофорезу у 12% ПААГ за присутності ДСН (рис. 7, А). Для контролю у сусідню лунку вносили IgG клінічно здорових донорів. Гель фарбували Coomassie R-250, після чого відповідні бенди вирізали та проводили ренатурацію IgG із гелю за наведеною методикою. Далі визначали сіалідазну активність ренатурованих IgG хворих на СЧВ та клінічно здорових донорів флюорометричним методом (рис. 7, Б). Показано, що сіаладазна активність IgG хворих на СЧВ зберігається після ренатурації антитіл із гелю; IgG здорових донорів слугували негативним контролем.
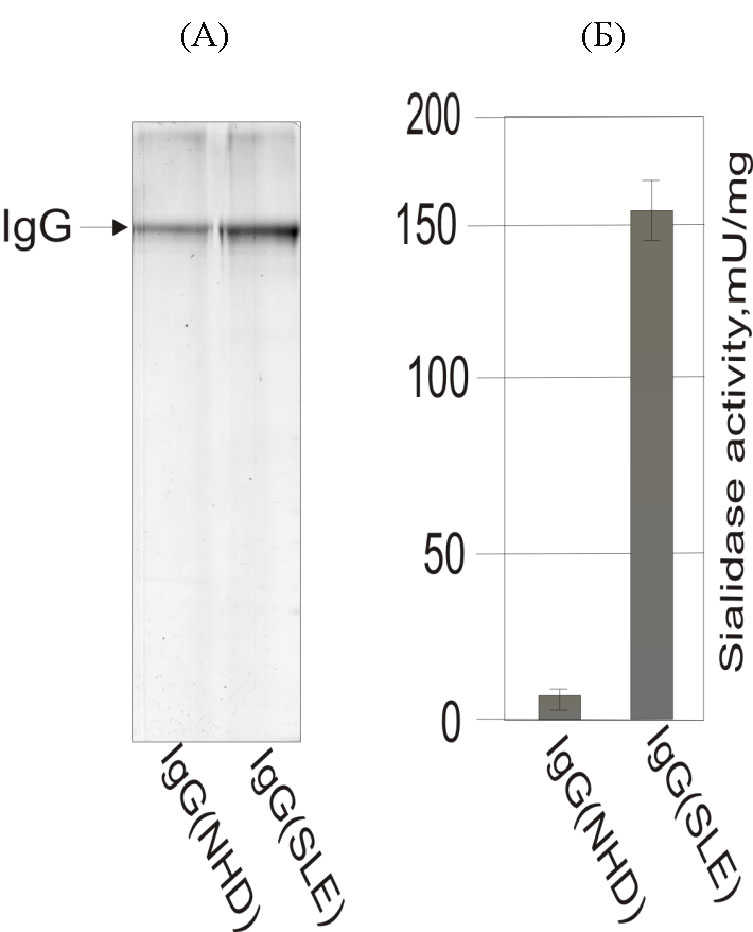
Рис. 7. Визначення сіалідазної активності IgG, денатурованих з ПААГ: (А) – електрофорез IgG клінічно здорових донорів (NHD) та хворих на СЧВ (SLE) у 12% ПААГ за присутності ДСН; (В) – визначення сіалідазної активності IgG клінічно здорових донорів та хворих на СЧВ флюорометричним методом.
Одержані результати додатково засвідчили, що IgG хворих на СЧВ являють собою антисіалільні абзими із ензиматичною активністю щодо залишків сіалових кислот.
3.6. Одержання (Fab)2 антисіалільних IgG-антитіл
Для того, аби остаточно переконатися, що сіалідазна активність є внутрішньою властивістю IgG, нами було одержано (Fab)2 цих антитіл. Очистку (Fab)2 проводили методом афінної хроматографії на муцин-сефарозі та трансферин-сефарозі. Як видно із профілю елюції (рис. 8, А), оптимальним сорбентом для виділення (Fab)2 анти-сіалільних антитіл є муцин-сефароза. Водночас (Fab)2 аналогічно до повних IgG не володіють спорідненістю до трансферин-сефарози. У подальшому одержані (Fab)2 вносили на протеїн G-сефарозу. Далі фракцію (Fab)2 анти-сіалільних антитіл аналізували шляхом електрофорезу у 12% ПААГ у нередукуючих умовах. Як видно з рис. 8, одержана фракція відповідає (Fab)2 IgG за молекулярною масою.
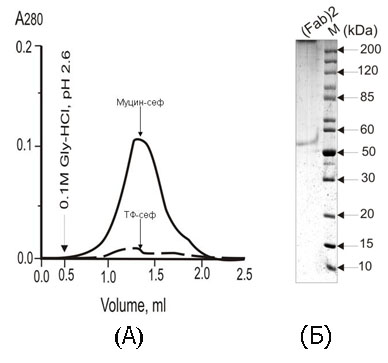
Рис. 8. Одержання (Fab)2 анти-сіалільних IgG: (А) – виділення (Fab)2 анти-сіалільних IgG методом афінної хроматографії на колонці із муцин-сефарозою (муцин-сеф) і трансферин-сефарозою (ТФ-сеф); (Б) – електрофорез (Fab)2 у 12% ПААГ за присутності ДСН. Стрілкою вказано місце нанесення буферу для елюції
