
- •Дипломна робота бакалавра
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2 30
- •1. Огляд літератури
- •1.1. Аутологічні антитіла, їх продукція та характеристики
- •1.2. Функціональна активність аутоантитіл у нормі та при аутоімунних захворюваннях
- •1.3. Аутоімунні захворювання
- •1.3.1. Системний червоний вовчак – системна імунопатія
- •1.3.2. Розсіяний склероз
- •1.4. Антитіла із каталітичною ензимоподібною активністю – абзими
- •Полісахарид-гідролізуючі абзими;
- •Абзими, що володіють сіалідазною активністю.
- •1.5. Роль процесів сіалування/десіалування у функціонуванні імунної системи
- •1.5.1. Структура та функції сіалових кислот
- •1.5.1.1. Структура сіалових кислот
- •1.5.1.2. Значення сіалових кислот для функціонування імунної системи
- •1.5.2. Вплив процесів сіалування-десіалування на структуру та функції імуноглобулінів
- •1.5.3. Анти-сіалільні антитіла у нормі та при патології
- •1.5.3.1. Абзими, що володіють сіалідазною активністю
- •2. Матеріали і методи досліджень
- •2.1. Реактиви і матеріали
- •2.2. Методи досліджень
- •2.2.1. Очищення антисіалільних IgG-антитіл із сироватки крові хворих на счв та рс
- •2.2.2. Одержання (Fab)2 антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2
- •2.2.4. Визначення сіалідазної (нейрамінідазної) активності IgG після ренатурації із пааг
- •2.2.5. Інгібування сіалідазної активності антисіалільних IgG-антитіл інгібіторами клітинних сіалідаз
- •2.2.6. Електрофоретичне розділення білків у пааг.
- •3. Результати досліджень та їх обговорення
- •3.1. Виділення та очистка IgG із сироватки крові хворих на счв та визначення їхньої сіалідазної активності
- •3.2. Виділення та очистка антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •3.3. Дослідження сіалідазної активності та субстратної специфічності антисіалільних IgG-антитіл
- •3.4. Інгібування сіалідазної активності антисіалільних IgG-антитіл
- •3.5. Визначення сіалідазної активності антисіалільних IgG-антитіл, ренатурованих з пааг
- •3.6. Одержання (Fab)2 антисіалільних IgG-антитіл
- •3.7. Визначення сіалідазної активності (Fab)2 антисіалільних IgG-антитіл
- •3.8. Дослідження сіалідазної активності антитіл сироватки крові хворих на розсіяний склероз
- •4. Охорона праці Вступ
- •4.1. Аналіз стану умов праці
- •4.1.1. Характеристика лабораторії
- •4.1.2.Аналіз методів дослідження та характеристика обладнання
- •4.1.3. Характеристика об'єкту дослідження, речовин, їхніх небезпечних властивостей
- •4.2. Організаційно–технічні заходи
- •4.2.1.Організація робочого місця і роботи
- •4.2.2. Санітарно–гігієнічні вимоги до умов праці
- •4.2.3. Заходи щодо безпеки під час роботи з обладнанням, об'єктом дослідження і речовинами
- •4.3. Безпека у надзвичайних ситуаціях
- •4.3.1. Протипожежні та проти вибухові заходи
- •4.3.2. Організація евакуації працівників
3.2. Виділення та очистка антисіалільних IgG-антитіл із сироватки крові хворих на счв
Таким чином, було встановлено, що IgG хворих на СЧВ володіють сіалідазною активністю. Однак виникло питання про те, чи ця ферментативна активність притаманна для всієї фракції IgG, чи лише для окремої субпопуляції. Із літературних джерел відомо, що в сироватці крові дітей, хворих на гострий лейкоз, виявлені антисіалільні IgG-антитіла, які володіли спорідненістю щодо муцину (сіаловмісного білка, який входить до складу слизових секретів усіх залоз) [46]. Окрім того, відомо, що білок плазми крові трансферин також характеризується високим ступенем сіалування. Ми припустили, що IgG-антитіла із сіалідазною активністю сироватки крові хворих на СЧВ належать до анти-сіалільних антитіл і тому можуть бути очищені афінною хроматографією на муцин-сефарозі та трансферин-сефарозі. Для доведення цього припущення ми розробили схему виділення анти-сіалільних IgG-антитіл із сироватки крові хворих на СЧВ і дослідили їхню сіалідазну активність. Алгоритм виділення є тристадійним: 1 – осадження із сироватки крові тотальної фракції імуноглобулінів шляхом трикратного висолювання; 2 – очистка білків афінною хроматографією на колонці з муцин-сефарозою або трансферин-сефарозою; 3 – хроматографія білків на колонці з протеїн G-сефарозою. Як видно із профілю елюції на рис. 3, оптимальним сорбентом для виділення анти-сіалільних антитіл є муцин-сефароза. Водночас ці антитіла не володіють спорідненістю до трансферин-сефарози, що може бути обумовлено прихованими сіалільними залишками трансферину.

Рис. 3. Виділення анти-сіалільних імуноглобулінів методом афінної хроматографії на колонках із муцин-сефарозою (муцин-сеф) та трансферин-сефарозою (ТФ-сеф). Стрілкою вказано місце нанесення буферу для елюції
У подальшому фракцію анти-сіалільних антитіл, отриманих на колонці із муцин-сефарозою, аналізували шляхом електрофорезу у 12% ПААГ за присутності ДСН у редукуючих та нередукуючих умовах (за наявності та відсутності β-меркаптоетанолу, відповідно). Для порівняння у гель вносили також тотальну фракцію імуноглобулінів, одержану шляхом трикратного висолювання, і фракцію IgG, одержану шляхом послідовного виділення на муцин- та протеїн G-сефарозі (рис. 4).
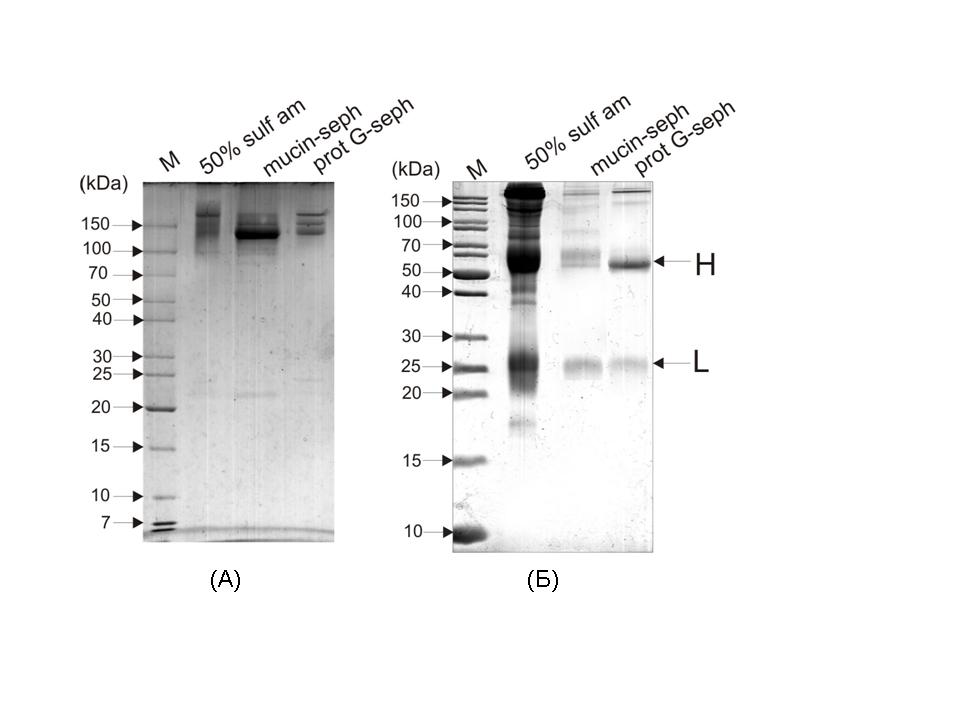
Рис. 4. Електрофорез препаратів імуноглобулінів із сироватки крові хворих на СЧВ у 12% ПААГ за присутності ДСН у нередукуючих (А) та редукуючих (Б) умовах: загальна фракція імуноглобулінів після трикратного висолювання (50% sulf am), фракція антитіл із муцин-сефарози (mucin-seph), фракція антитіл після муцин- та протеїн-G сефарози (prot G-seph), стандартні маркери молекулярних мас (М).
Як видно з електрофореграм (рис. 4), тристадійний алгоритм виділення дозволяє одержати антитіла, що належать до класу імуноглобулінів G і володіють спорідненістю до сіалових залишків муцину.
3.3. Дослідження сіалідазної активності та субстратної специфічності антисіалільних IgG-антитіл
У подальшому фракцію анти-сіалільних антитіл використано для дослідження їхньої сіалідазної активності, а саме здатності гідролізувати синтетичний субстрат сіалідаз – 2’-(4-метилумбеліферил)-α-D-нейрамінат натрію. Для визначення сіалідазної активності використано сироватку крові хворих на СЧВ, загальну фракцію імуноглобулінів, фракцію імуноглобулінів, очищену на муцин-сефарозі та IgG, одержані шляхом послідовної очистки на муцин- і протеїн G-сефарозі (рис. 5).
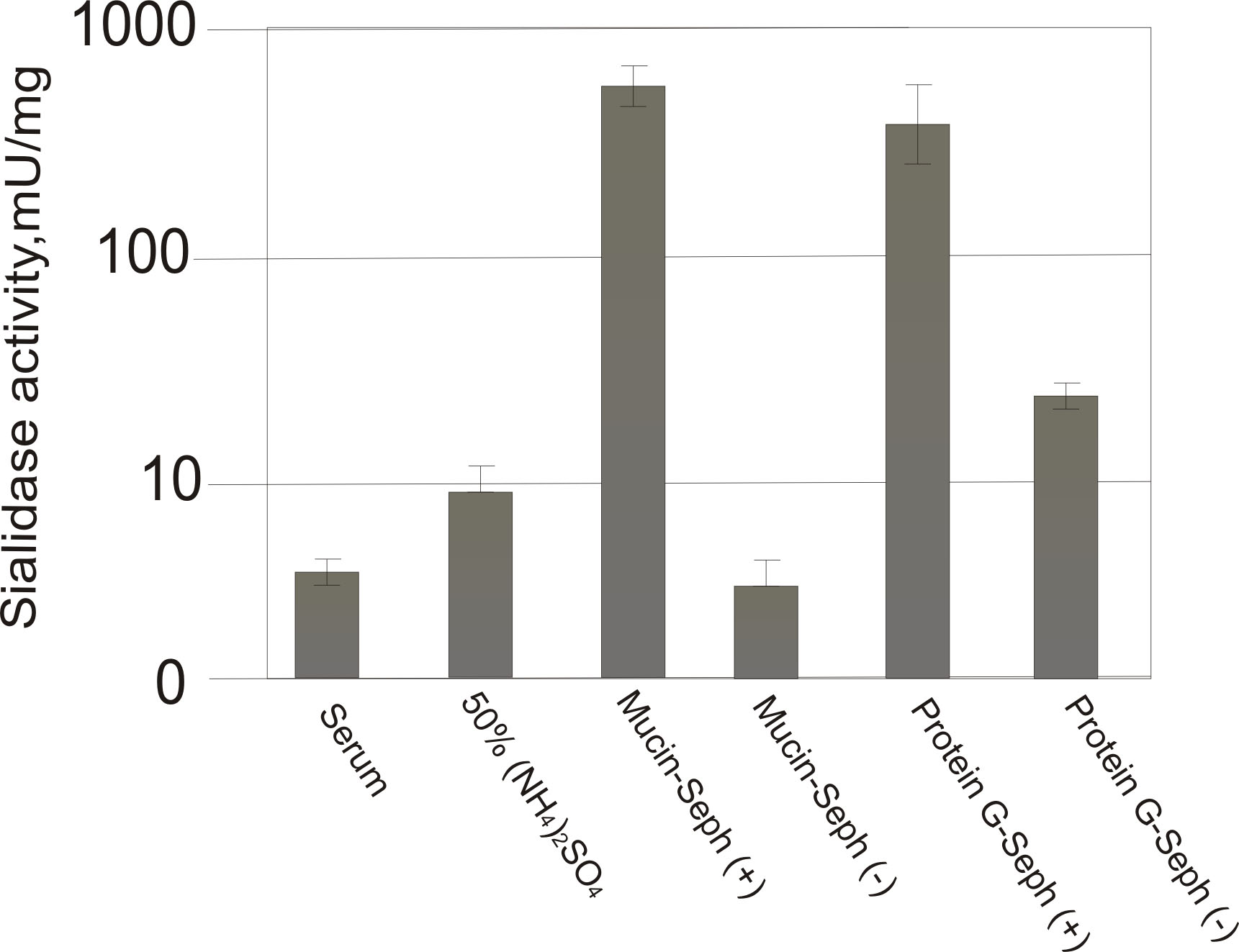
Рис. 5. Флюорометричне визначення сіалідазної активності антитіл сироватки крові хворих на СЧВ: Serum – плазма крові; 50% (NH4)2SO4 – загальна фракція імуноглобулінів після трикратного висолювання; Mucin-Seph (+) – фракція імуноглобулінів, очищена на муцин-сефарозі; Mucin-Seph (-) – проскок із муцин-сефарози; Protein G-Seph (+) – IgG, одержані шляхом послідовної очистки на муцин- і протеїн G-сефарозі; Protein G-Seph (-) – проскок із протеїн G-сефарози.
Як видно із рис. 5, антитіла із сироватки крові хворих на СЧВ володіють сіалідазною активністю і належать анти-сіалільних абзимів. Сіалідазна активність цих антитіл зростає в міру їхньої очистки і досягає максимального значення після афінної хроматографії на муцин-сефарозі.
