
- •Дипломна робота бакалавра
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2 30
- •1. Огляд літератури
- •1.1. Аутологічні антитіла, їх продукція та характеристики
- •1.2. Функціональна активність аутоантитіл у нормі та при аутоімунних захворюваннях
- •1.3. Аутоімунні захворювання
- •1.3.1. Системний червоний вовчак – системна імунопатія
- •1.3.2. Розсіяний склероз
- •1.4. Антитіла із каталітичною ензимоподібною активністю – абзими
- •Полісахарид-гідролізуючі абзими;
- •Абзими, що володіють сіалідазною активністю.
- •1.5. Роль процесів сіалування/десіалування у функціонуванні імунної системи
- •1.5.1. Структура та функції сіалових кислот
- •1.5.1.1. Структура сіалових кислот
- •1.5.1.2. Значення сіалових кислот для функціонування імунної системи
- •1.5.2. Вплив процесів сіалування-десіалування на структуру та функції імуноглобулінів
- •1.5.3. Анти-сіалільні антитіла у нормі та при патології
- •1.5.3.1. Абзими, що володіють сіалідазною активністю
- •2. Матеріали і методи досліджень
- •2.1. Реактиви і матеріали
- •2.2. Методи досліджень
- •2.2.1. Очищення антисіалільних IgG-антитіл із сироватки крові хворих на счв та рс
- •2.2.2. Одержання (Fab)2 антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •2.2.3. Флуориметричне вимірювання сіалідазної (нейрамінідазної) активності IgG і (Fab)2
- •2.2.4. Визначення сіалідазної (нейрамінідазної) активності IgG після ренатурації із пааг
- •2.2.5. Інгібування сіалідазної активності антисіалільних IgG-антитіл інгібіторами клітинних сіалідаз
- •2.2.6. Електрофоретичне розділення білків у пааг.
- •3. Результати досліджень та їх обговорення
- •3.1. Виділення та очистка IgG із сироватки крові хворих на счв та визначення їхньої сіалідазної активності
- •3.2. Виділення та очистка антисіалільних IgG-антитіл із сироватки крові хворих на счв
- •3.3. Дослідження сіалідазної активності та субстратної специфічності антисіалільних IgG-антитіл
- •3.4. Інгібування сіалідазної активності антисіалільних IgG-антитіл
- •3.5. Визначення сіалідазної активності антисіалільних IgG-антитіл, ренатурованих з пааг
- •3.6. Одержання (Fab)2 антисіалільних IgG-антитіл
- •3.7. Визначення сіалідазної активності (Fab)2 антисіалільних IgG-антитіл
- •3.8. Дослідження сіалідазної активності антитіл сироватки крові хворих на розсіяний склероз
- •4. Охорона праці Вступ
- •4.1. Аналіз стану умов праці
- •4.1.1. Характеристика лабораторії
- •4.1.2.Аналіз методів дослідження та характеристика обладнання
- •4.1.3. Характеристика об'єкту дослідження, речовин, їхніх небезпечних властивостей
- •4.2. Організаційно–технічні заходи
- •4.2.1.Організація робочого місця і роботи
- •4.2.2. Санітарно–гігієнічні вимоги до умов праці
- •4.2.3. Заходи щодо безпеки під час роботи з обладнанням, об'єктом дослідження і речовинами
- •4.3. Безпека у надзвичайних ситуаціях
- •4.3.1. Протипожежні та проти вибухові заходи
- •4.3.2. Організація евакуації працівників
2.2.5. Інгібування сіалідазної активності антисіалільних IgG-антитіл інгібіторами клітинних сіалідаз
До 150 мкл зразку, у якому визначали активність, додавали 50 мкл 0,5 мМ 4-метилумбеліферилнейрамінату натрію, інгібітори 15 μM DANA (2-дезокси-2,3-дидегідро-N-ацетилнейрамінова кислота) або 15 μM озельтамівір та інкубували при 37о С протягом 1-2 годин (рис. 3) [55]. Зразок розводили на 0,2 М ацетатному буфері із 5 мМ CaCl2 та 5мМ MgCl2, рН 4,2. Для зупинки реакції до реакційної суміші додавали 1 мл гліцинового буферу (рН 10,7) із 60 мМ NaCl та 166 мМ Na2CO3. Флуориметрію проводили із використанням фільтрів довжин збудження та випромінювання, характерних для 4-метилумбеліферолу.

Рис. 3. Схема будови інгібіторів сіалідаз DANA (1) та озельтамівір (2) [55]
2.2.6. Електрофоретичне розділення білків у пааг.
Електрофорез очищених препаратів білків проводили в блоках 12 % ПААГ у буферній системі Лемлі за присутності ДСН. Зразки і білкові стандарти вносились за допомогою шприца на дно лунок в розрахунку 5 мкг білка на одину доріжку. Для приготування зразків використовували 4х Леммлі буфер:
0,5 M трис-HCl, pH 6,8
20 % гліцерин
20 % ДСН
1 % бромфеноловий синій
8 % β-меркаптоетанол.
Електрофорез вели при силі струму 20 мА на пластину протягом 2 год.
Після електрофорезу гелі забарвлювали для виявлення розділених білків за допомогою фарби, до складу якої входили: 0,2 % Coomassie R-250 або G-250, 20 % метанолу та 10 % оцтової кислоти, протягом 20 хв з наступним відмиванням у 20 % метанолі та 5 % оцтовій кислоті при помішуванні. Використовували стандарти молекулярної маси білків: Unstained Precision Protein Standards („BioRad”), Protein Molecular Weight Markers („Fermentas”).
3. Результати досліджень та їх обговорення
3.1. Виділення та очистка IgG із сироватки крові хворих на счв та визначення їхньої сіалідазної активності
Було обстежено 65 пацієнтів із системним червоним вовчаком, серед них 55 (84,7%) жінок та 10 (15,3%) чоловіків віком від 17 до 65 років, середня тривалість хвороби складала 6 років та два місяці. Діагноз СЧВ виставляли відповідно до рекомендацій АCR (1997). Контрольну групу склало 10 клінічно здорових донорів відповідного віку та статті. Із крові хворих та клінічно здорових донорів шляхом тристадійного висолювання 50% (NH4)2SO4 отримували тотальну фракцію імуноглобулінів, яку перевіряли на сіалідазну (нейрамінідазну) активність флюорометричним методом. Показано, що антитіла хворих на СЧВ проявляють високу сіалідазну активність, натомість імуноглобуліни здорових донорів зовсім неактивні. Виникло питання про те, які саме імуноглобуліни проявляють зазначену активність. Тому наступна стадія дослідження включала афінну хроматографію тотальної фракції імуноглобулінів на колонці, яка містить протеїн G-сефарозу – сорбент, специфічний для виділення IgG. IgG, виділені із сироватки крові хворих на СЧВ, досліджували методом гель-електрофорезу у 12% ПААГ за присутності ДСН. Як видно з рис. 1, одержані фракції IgG є електрофоретично гомогенними, за молекулярною масою відповідають імуноглобулінам класу G та позбавлені домішок чи забруднень. Отже, метод афінної хроматографії на колонці із протеїн G-сефарозою є ефективним для виділення IgG із сироватки крові хворих на СЧВ.
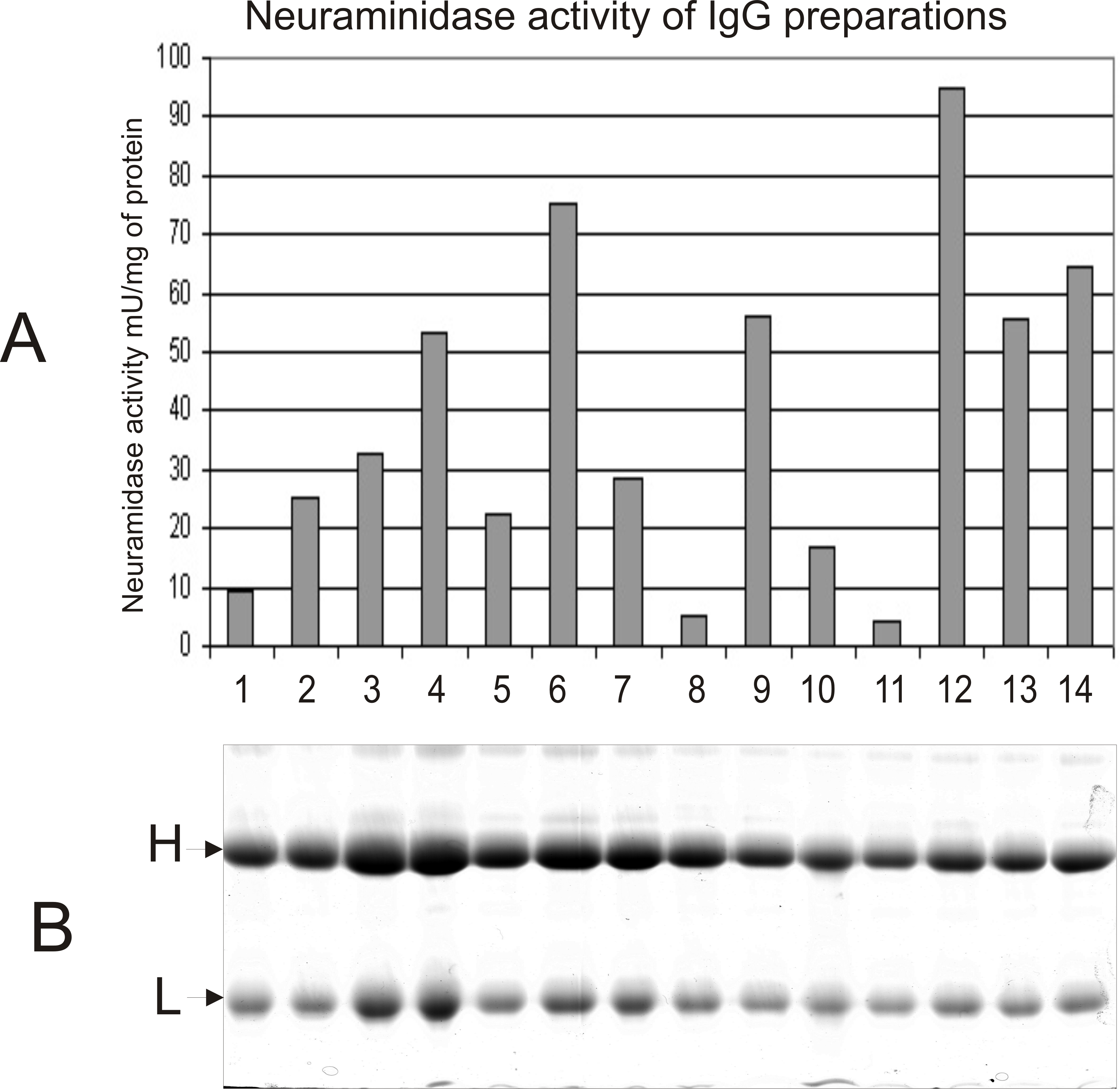
Рис. 1. Отримання високо очищених препаратів IgG-антитіл із сироватки крові хворих на СЧВ методом афінної хроматографії білків на колонці із протеїн G-сефарозою
Далі досліджували сіалідазну активність високо очищених препаратів IgG флюорометричним методом (рис. 2). Субстратом слугував 2’-(4-метилумбеліферил)-α-D-нейрамінат натрію. Час ферментативної реакції становив 3 години. Як видно з рис. 2, усі препарати IgG хворих на СЧВ характеризуються певним рівнем сіалідазної активності. Відмінність у рівні сіалідазної активності IgG може бути пов’язана із ступенем важкості перебігу захворювання.
Рис. 2. Визначення сіалідазної активності препаратів IgG, очищених із сироватки крові хворих на СЧВ
